人体内DNA损伤修复(DDR)过程主要有两种机制:(1)聚腺苷二磷酸核糖聚合酶(PARP)参与的DNA单链断裂后的损伤修复;(2)BRCA1/2基因参与的同源重组(HR)修复(双链修复)。这两种DNA损伤修复机制保障了遗传物质复制、细胞分裂等过程的顺利进行。两种修复机制中的一种发生修复过程障碍时,另一种机制则可以代偿修复。如果PARP参与的单链损伤修复和HR修复两个通路均出现障碍,则导致细胞死亡,这被称为“合成致死”效应。
因此,对于存在HR缺陷(HRD)的肿瘤细胞,例如BRCA1/2基因突变的细胞,PARP抑制剂可通过此“合成致死”效应促进细胞的凋亡。另一方面,PARP抑制剂能够捕获DNA单链断裂位点处的PARP酶,使PARP保持对DNA的结合,这一过程被称为DNA-PARP复合物的“捕获(trapping)”,从而导致DNA-PARP复合物长期存在,从而阻断后续DNA 的修复。越来越多的临床研究表明,PARP抑制剂的作用不仅限于BRCA突变或HRD阳性的卵巢癌患者,铂敏感复发的卵巢癌患者也可从中获益,其机制可能与PARP抑制剂的捕获作用有关。
一. BRCA检测的意义
BRCA1/2基因突变分为胚系突变(gBRCAm)和体系突变(sBRCAm)两种。gBRCA1/2突变起源于生殖细胞,存在于机体的每一个细胞中;sBRCA1/2突变仅存在于肿瘤细胞中,进行肿瘤组织检测可以同时获得胚系及体细胞BRCA1/2突变信息。PARP抑制剂的Study19、NOVA和ARIEL3相关临床研究表明,gBRCAm和sBRCAm铂敏感复发卵巢癌患者从PARP抑制剂中获益相似,无进展生存期(PFS)疗效评估具有相似的风险比,sBRCAm患者也可以长期获益于PARP抑制剂维持治疗。
BRCA1/2胚系突变还与肿瘤的遗传易感性相关。携带有gBRCAm的女性,卵巢癌发生风险提高10~30倍。明确卵巢癌患者的BRCA1/2胚系突变状态,有助于对患者及其家系进行遗传风险管理,包括家系验证、制定筛查方案、化学预防、预防性手术、生殖干预等。
对于任何期别的卵巢癌患者,如确定存在gBRCAm,应进一步评估其家庭成员的癌症风险。胚系DNA测序是最敏感的方法。如果胚系DNA的BRCA突变阴性,则应对肿瘤组织的DNA 进行测序,因有5%的女性存在sBRCAm。
肿瘤组织检测可同时获得胚系及体细胞BRCA1/2的突变信息,对于突变检测阳性的患者建议进一步行胚系突变分析,以区分胚系或体细胞突变。肿瘤检测一般使用手术或穿刺获得的肿瘤组织样本,胚系检测一般使用血液、唾液、口腔拭子等样本,目前以血液为主。
但BRCA1/2突变并不能涵盖所有能从PARP抑制剂中获益的人群。在体内正常细胞中,DNA 双链断裂是通过HR修复通路完成修复。HR是一种涉及许多基因产物的复杂过程。BRCA1/2基因只是编码同源重组修复的关键组分之一,其中还涉及其他基因,包括RAD51、ATM、MRE11、RPA和NBS1等基因,这些基因发生突变失活同样导致DNA双链损伤修复功能的缺陷,即HRD。
二. HRD检测
同源重组修复(HRR)是正常细胞修复DNA双链断裂损伤(DSB)的重要途径,HRD导致细胞DNA双链断裂损伤修复途径缺陷,表现为对引起DNA断裂的铂类药物以及PARP抑制剂高度敏感,因而HRD作为PARP抑制剂敏感的生物标志物已应用于临床。HRR通路相关的基因突变是导致HRD的主要原因,卵巢癌中常见的HRR突变,可能导致细胞对PARP抑制剂敏感。在几项卵巢癌PARP抑制剂相关的临床研究中,同样得到了证实(表1)。
表1. HRR突变和卵巢癌PARP抑制剂敏感性
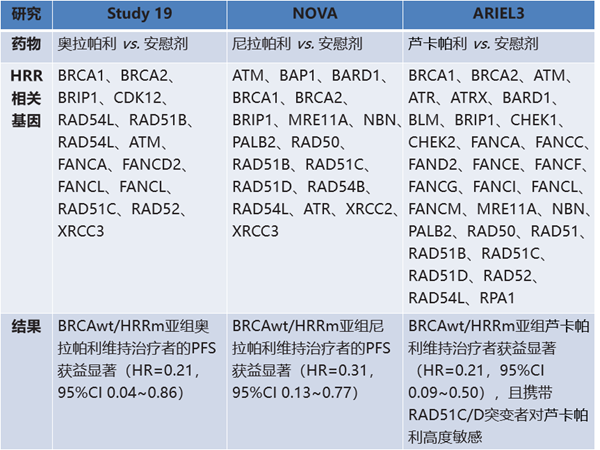
wt:野生型;m:突变型。
HRD可通过同源重组相关基因突变检测和基因瘢痕检测两种方式判断。目前PARP抑制剂临床试验中的HRD检测采用用二代测序(NGS)方法,通常包括两个部分,BRCA1/2突变状态及基因组不稳定性状态评分(GIS),或称HRD评分。对于后者,一般通过对细胞内单核苷酸多态性位点(SNP)进行检测和计算得出。全球范围内仅有两种HRD检测产品,HRD阳性定义见表2。HRD检测可以使PARP抑制剂敏感人群从占20%左右的BRCA突变人群扩大到占50%左右的HRD阳性人群。
表2. HRD检测及阳性定义

LOH:杂合性丢失;TAI:端粒等位基因失平衡;LST:大片段迁移。
三. HRD与“铂敏感”
那么,检测同源重组修复通路基因突变是否是预测PARP抑制剂疗效的充分指标?答案是否定的。从合成致死的原理上,PARP抑制剂可以在所有的HRD肿瘤细胞中发挥作用。目前检测同源重组修复通路基因突变存在局限性,HRD阴性者仍能从PARP抑制剂治疗中获益。目前PARP抑制剂适应证中的“铂敏感”的概念即与HRD密切相关,即所有的铂敏感复发患者能够从PARP抑制剂的维持治疗中获益。虽然目前HRD检测手段存在一定的局限性,但更好地理解PARP抑制剂适应证与HRD的关系,对未来卵巢癌精准靶向治疗是有益的。由此提出了“铂敏感”是否更适合作为预测PARP抑制剂疗效的指标。目前三种PARP抑制剂用于复发卵巢癌患者的适应证均以“铂敏感”为指征。在Study19、NOVA研究和ARIEL3研究中,奥拉帕利、尼拉帕利和雷卡帕尼均使铂敏感复发卵巢癌患者显著获益。
四. 小结
对于卵巢癌的治疗,PARP抑制剂之所以有从BRCA1/2突变到 HRD、铂敏感的变迁,从最开始的需要检测到不再强调BRCA1/2检测,是因为BRCA1/2突变或HRD并不能完全涵盖所有能从PARP抑制剂中获益的患者。BRCA1/2突变和HRD大多为胚系突变和家族遗传,其发生比例远低于“铂敏感”的范围,其原因并不清楚,因而仍有许多待解决的问题。
相比之下,“铂敏感”指征在一定程度上避免了BRCAm和HRD检测的不足,是一个能很好地预测PARP抑制剂获益的临床指标。然而,依据疾病进展时间间隔的“铂敏感”可能受到诸多因素的影响,缺乏确切判定“铂敏感”的生物学证据,这仍须进一步的深入研究,才能更好地理解PARP抑制剂的适应证。
参考文献
1. 欧阳振波, 尹倩, 钟碧婷, 张敏. AGOC关于上皮性卵巢癌胚系和体系肿瘤检测的指南解读[J/OL]. 现代妇产科进展.
2. 李宁,吴令英. PARP抑制剂在上皮性卵巢癌的应用现状[J]. 实用妇产科杂志, 2020, 36(02): 88-92.
3. 张国楠,黄建鸣. 对卵巢癌治疗中PARP抑制剂适应证从BRCA突变到HRD、铂敏感变迁的思考[J]. 中国实用妇科与产科杂志, 2019, 35(05): 551-553.
4. 鹿欣, 姜洁, 李宁, 王新宇, 高庆蕾, 黄鹤, 刘继红, 孔北华, 谢幸, 马丁. 卵巢癌PARP抑制剂临床应用指南[J]. 中国医学前沿杂志(电子版), 2020, 12(05) :29-37.
5. 温灏, 吴焕文. 上皮性卵巢癌PARP抑制剂相关生物标志物检测的中国专家共识[J]. 中国癌症杂志, 2020, 30(10): 841-848.
[6] 张国楠,黄建鸣.BRCA、HRD与PARP抑制剂:卵巢癌临床研究中的相关问题与思考[J]. 中国实用妇科与产科杂志, 2020, 36(01): 40-44.
 妇产科在线APP下载
妇产科在线APP下载













