《妇瘤新视野》栏目是由首都医科大学附属北京妇产医院妇瘤科吴玉梅教授团队与妇产科在线合作推出的精品妇科肿瘤栏目,以典型、疑难或少见的妇科肿瘤疾病的诊断治疗分析为切入重点,串联起相关知识点,将妇科肿瘤疾病的诊断治疗进展与广大读者分享,开阔临床医生视野,提高临床诊疗能力。
作者:刘洋 吴玉梅(吴玉梅教授知名专家团队)
审校:吴玉梅
单位:首都医科大学附属北京妇产医院妇瘤科
一. 背景
有数据表明,子宫内膜癌(EC)的发病率在世界范围内呈上升趋势。以美国为例,2013年至2020年间,子宫内膜癌的新发病例数由49560例上升至65620例[1,2],其中约14%的患者为绝经前女性,约5%的患者年龄小于40岁,其中约70%未生育[1]。
而且随着全球生育年龄的推迟,越来越多的年轻女性在确诊时尚未完成生育。以人口老龄化最严重的日本为代表,相比1975年的头胎平均生育年龄(25.7岁),2018年女性生育第一个孩子的平均年龄推迟了5岁(30.7岁)[1]。早期子宫内膜癌患者的一线治疗方法为全子宫+双附件切除术,手术使年轻患者彻底丧失生育功能。
二. 以孕激素为基础的保留生育功能治疗,为渴望生育的年轻早期子宫内膜癌患者带来希望
年轻的早期子宫内膜癌患者保留生育功能具有可行性[1-3]:(1)雌激素依赖型肿瘤居多,对性激素治疗反应好;(2)分期早,分化好;3)预后一般较年龄较大的女性好;(4)早期子宫内膜癌患者的预后较好,5年生存率可达到92% [1]。
综上,NCCN 2021 v1版指南规定了保留生育治疗必须符合以下条件[1]:(1)病理类型:子宫内膜样腺癌,高分化;(2)磁共振成像(MRI)(首选)或经阴道超声提示病灶局限于子宫内膜;(3)影像学检查未发现可疑转移灶;(4)无药物治疗或妊娠禁忌证;(5)充分告知保守治疗非标准治疗及相关风险。
子宫内膜癌5年生存率(2009-2015, US)
三. 保留生育功能治疗的安全性
一项荟萃分析数据(MEDLINE 1950 to 2011, EMBASE 1980 to 2011, Cochrane 1990 to 2011)表明,保守治疗的缓解率约为76.2%(95%CI 68%~85.3%),复发率为40.6%(95%CI 33.1%~49.8%)[1]。
Maria等[1]的研究显示,越来越多的年轻早期子宫内膜癌患者选择保留生育治疗,从2004年的2.4%上升至 2014年的5.9%,在<35岁的子宫内膜癌患者中约18%选择了内分泌保留生育功能治疗。本研究表明,保留生育功能治疗可能导致IB期子宫内膜癌患者的5年生存率下降(保守治疗组 vs. 手术组:75% vs. 97.5%),而对于IA期女性,手术组和保留生育功能治疗组的5年生存率无显著差异。
另一项源自SEER数据库(1993-2012)的荟萃分析显示,在长达15年的随访中,低级别子宫内膜癌年轻女性(包括IA、IB期,G1-2)中,保留生育功能治疗组与手术治疗组之间的全因死亡率无明显差异[1]。
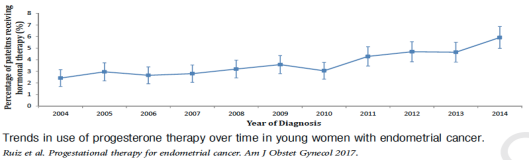
综上,在决定保留生育功能治疗之前,应与患者充分讨论风险与获益。目前证据对子宫内膜癌患者保留生育治疗的安全性仍有分歧,考虑对IA期患者相对更安全,IB期患者可能会增加死亡风险。
四. 保留生育功能治疗的风险
然而,保留生育功能治疗之路也并非一帆风顺!即使是满足了指南中规定的所有标准,保留生育功能仍存在病情进展以及保守治疗失败的风险。
首先,诊刮病理具有取材不全的局限性,全子宫切除术后病理与术前诊刮病理相比存在病变升级的情况。有文献报道,约14.7%的高分化癌患者术后升级为中-低分化癌,而约1.2%的子宫内膜样癌患者术后升级为特殊类型癌(浆液性、透明细胞癌)[1]。
其次,目前尚没有一种手段可以精准预测预后并指导这类患者的临床决策。随着基因组学的发展,对子宫内膜癌的认识逐渐从过去的病理形态学向病理-分子遗传学特征分型过度。Britton等的研究发现,基于TCGA分子分型改良版的ProMisE(Proactive Molecular Risk Classifier for Endome-trial Cancer)[1]分型系统弥补了手术病理分期的局限性,与之协同应用可更好地预测预后,对有生育需求的子宫内膜癌患者具有一定的临床指导意义。研究认为,POLE超突变组具有良好的临床结局,而低拷贝数变异型(相当于p53野生型)可能是内分泌治疗最大的获益者[1]。
再次,决定保守治疗前的影像学评估至关重要。尽管影像学技术已经很精准,但仍受分辨力及医师经验影响,具有一定局限性。有数据显示,判断子宫内膜病灶肌层浸润,经阴道超声的敏感度为68%~100%,特异度为71%~90%。判断宫颈间质浸润,经阴道超声的敏感度为19%~100%,特异度为86%~99% [2]。目前证据显示,MRI 与经阴道超声在术前评估子宫内膜、宫颈浸润方面无差异。但由于MRI 对软组织的分辨能力较强,可同时评估子宫、卵巢和盆腔淋巴结状态,因此,推荐有条件的情况下首选MRI 增强。未行手术分期,单凭影像学评估存在实际期别高于临床分期、延误更晚期患者治疗的情况。
五. 保留生育功能治疗的生育结局
保留生育功能治疗的患者,其生育结局如何是临床医师与患者共同关注的重要问题。除外子宫内膜病变这一不孕因素,子宫内膜癌患者常合并有导致不孕的其他因素,如多囊卵巢综合征(PCOS)、不排卵、月经不规则、应用大剂量孕激素、反复内膜活检等。以上因素均可导致这类患者难以受孕,且往往需要辅助生殖技术助孕。
一项有关早期子宫内膜癌和子宫内膜非典型增生患者的荟萃分析显示,其妊娠率为31.6%,其中54.1%的患者接受了辅助生殖技术,26.1%的患者为自然受孕。另外,年龄、肥胖、既往不孕史等因素与疾病复发率、妊娠率无关,因此不应作为保留生育功能治疗的禁忌[2]。另一项研究显示,保留生育功能治疗患者的活产率约28% [10]。
六. 保留生育功能治疗的手段
目前的主要治疗手段分为口服药物治疗、置入左炔诺孕酮宫内节育装置、病灶切除+药物治疗,同时辅以体重管理。
(一)口服药物
常用的口服药物治疗包括醋酸甲羟孕酮(MPA)400~600 mg/d、醋酸甲地孕酮(MA)160~320 mg/d,但传统的口服药物具有体重增加、头痛、阴道出血及血栓形成的缺点。
(二)左炔诺孕酮宫内节育装置(LNG-IUD)
LNG-IUD自2014年纳入NCCN指南推荐,目前的应用方法分为单纯应用 LNG-IUD治疗、LNG-IUD联合芳香化酶抑制剂治疗。LNG-IUD治疗的优点如下:(1)直接作用于子宫内膜;(2)血液中孕激素含量低;(3)发生体重增加、血栓性疾病风险小;(4)可作为暂无生育要求患者的维持治疗。其局限性包括:(1)子宫明显增大的患者需慎重使用,有研究表明子宫深度>9 cm与低缓解率有关 ;(2)IUD在子宫内膜透明细胞癌(ECC)患者中应用证据不足,现有研究样本量小,且全为回顾性研究。
单纯应用LNG-IUD治疗高中分化子宫内膜癌患者的完全缓解率分别为67%~81.3%和75%[1-2]。一项荟萃分析表明,LNG-IUD联合GnRHa/口服孕激素治疗患者的妊娠率为56%,复发率为11.0%[3]。北京协和医院开展的一项关于GnRHa+芳香化酶抑制剂来曲唑治疗肥胖(体重指数BMI:35.0±1.4 kg/m2)子宫内膜癌患者的研究,共纳入6例患者,完全缓解率达100%,妊娠率为50.0%,活产率达75.0% [4]。
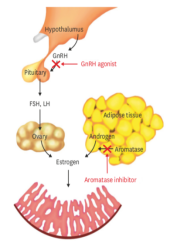
GnRHa+芳香化酶抑制剂的治疗原理:其可同时抑制以下两条通路,(1)GnRHa阻断下丘脑-垂体-卵巢性腺轴,(2)芳香化酶抑制剂阻断脂肪中的睾酮转变为雌激素途径。
(三)病灶切除+药物治疗
复旦大学附属妇产科医院关于宫腔镜下病灶切除联合孕激素治疗子宫内膜癌和子宫内膜不典型增生年轻女性的疗效观察显示,完全缓解率达97.3%,妊娠率为37.5%,复发率为11.1%。病灶近输卵管开口、病灶数量与预后无关,病灶>2 cm与不良结局相关[5]。
这种治疗方法的优点如下:(1)切除病灶具有一定深度,可同时评估病灶浸润深度;(2)避免对无病灶部分基底层的破坏,有助于受孕。其局限性包括对位于宫角及宫底部位的病灶切除困难、样本量小、缺乏前瞻性随机对照研究。
(四)体重管理
一项多中心的回顾性研究表明,孕激素治疗期间的体重变化对病情完全缓解、复发、妊娠、活产率影响不大。然而,治疗前和治疗后BMI ≥25 kg/m2是治疗效果差和复发率高的重要预测因子[6]。因此,在孕激素治疗期间,维持患者的正常BMI 至关重要。
七. 小结
子宫内膜癌保留生育功能的治疗为生育期女性带来了福音,但保守治疗并不等于“一劳永逸”,仅作为完成生育前的“缓兵之计”,并且风险与获益并存,患者需充分知情。早期子宫内膜癌患者保留生育功能治疗具有一定的安全性,但临床医师在治疗前要进行充分评估,慎重筛选具备适应证的患者。目前,虽然治疗手段多种多样,但多数缺乏高质量的研究数据支持,如何有针对性的选择治疗手段仍是临床医师面临的难题。
参考文献
1. Zoe R Greenwald, Lina N Huang, Michel D Wissing, Eduardo L Franco, Walter H Gotlieb. Does hormonal therapy for fer-tility preservation affect the survival of young women with early-stage endometrial cancer? [J] Cancer. 2017, 123(9): 1545-1554. doi: 10.1002/cncr.30529.
2. Leitao MM Jr, Kehoe S, Barakat RR, et al. Comparison of D&C and office endometrial biopsy accuracy in patients with FIGO grade 1 endometrial adenocarcinoma [J]. Gynecol Oncol 2009; 113: 105-108.
3. Aline Talhouk, Melissa K McConechy, Samuel Leung, et al. Confirmation of ProMisE: A simple, genomics-based clinical classifier for endometrial cancer [J]. Cancer. 2017, 123(5): 802-813.
4. Britton H, Huang L, Lum A, et al. Molecular classification defines outcomes and opportunities in young women with endo-metrial carcinoma [J]. Gynecol Oncol, 2019, 153(3): 487-495.
5. Wu LM, Xu JR, Gu HY, et al. Predictive value of T2-weighted imaging and contrast-enhanced MR imaging in assessing myometrial invasion in endometrial cancer: a pooled analysis of prospective studies [J]. Eur Radiol 2013; 23: 435-49.
6. Martin Koskas, Jennifer Uzan, Dominique Luton, Roman Rouzier, Emile Daraï. Prognostic factors of oncologic and repro-ductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and meta-analysis. Fertil Steril. 2014, 101(3): 785-94.
7. Navdeep Pal, et al. Treatment of Low-Risk Endometrial Cancer and Complex Atypical Hyperplasia With the Levonorgestrel-Releasing Intrauterine Device. Obstet Gynecol. 2018, 131(1): 109-116.
8. Umberto Leone Roberti Maggiore et al. Efficacy and fertility outcomes of levonorgestrel-releasing intra-uterine system treat-ment for patients with atypical complex hyperplasia or endometrial cancer: a retrospective study [J]. J Gynecol Oncol. 2019, 30(4): e57.
9. Zunpan Fan, Hui Li, Rui Hu, et al. Fertility-Preserving Treatment in Young Women With Grade 1 Presumed Stage IA En-dometrial Adenocarcinoma: A Meta-Analysis[J]. Int J Gynecol Cancer. 2018, 28(2): 385-393.
10. Zhang Z, Huang H, Feng F, et al. A pilot study of gonadotropin-releasing hormone agonist combined with aromatase in-hibitor as fertility-sparing treatment in obese patients with endometrial cancer. J Gynecol Oncol. 2019; 30(4): e61.
11. Bingyi Yang, Yuhui Xua, Qin Zhu, et al. Treatment efficiency of comprehensive hysteroscopic evaluation and lesion resec-tion combined with progestin therapy in young women with endometrial atypical hyperplasia and endometrial cancer [J]. Gyne-cologic Oncology,153 (2019): 55-62.

吴玉梅,主任医师、二级教授、博士生导师,首都医科大学附属北京妇产医院妇瘤科主任。
学术兼职:中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长。
擅长领域:致力于妇科肿瘤临床、科研和教学工作。
主要研究方向:宫颈癌放射敏感及放射抵抗机制、妊娠合并宫颈病变的筛查策略、妇科恶性肿瘤的预防。
科研成果:发表妇科肿瘤相关SCI论文30余篇,中文核心期刊论文100余篇;主持国家基金、省科技重点研发项目等多项,获省部级科技奖3项,国家发明专利1项。
个人荣誉:全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。

刘洋,硕士,住院医师,师从吴玉梅教授,现就职于首都医科大学附属北京妇产医院妇瘤科,发表核心期刊论文3篇、SCI 论文1篇,主持院级课题1项。
吴玉梅教授妇科肿瘤知名专家团队简介
首都医科大学附属北京妇产医院妇瘤科是国家重点科室,每年诊治妇科恶性肿瘤患者上千例,拥有北京市唯一的妇科肿瘤临床及组织样本库。是全国少数可进行手术、放疗、化疗、靶向及免疫等综合性治疗的科室。目前拥有多项国际及国家临床试验进行中。
吴玉梅教授从事妇科肿瘤临床工作30余年,致力于妇科肿瘤如宫颈癌、卵巢癌及子宫内膜癌等疑难杂症相关研究,擅长宫颈癌及癌前病变、子宫恶性肿瘤、卵巢良恶性肿瘤以及妊娠期合并妇科肿瘤的诊断及治疗,包括手术、放疗、化疗、内分泌治疗、靶向治疗及免疫治疗等;现兼任中华医学会妇科肿瘤分会委员、北京医学会妇科肿瘤学分会副主任委员、北京妇产学会外阴阴道疾病分会副主委、北京医学会肿瘤学分会委员、中国老年医学学会妇科分会会长等职务,国务院特贴专家;主持国家级、省部级等多项课题;出版专著2部,发表学术论文100余篇发表SCI 文章30余篇,多次获得妇幼健康科技成果奖和华夏医学科学技术奖;获得的个人荣誉包括全国医德标兵、北京市先进工作者、北京市三八红旗奖章等。
吴玉梅教授领衔的妇科肿瘤知名专家团队,成员有主任医师、副主任医师、主治医师、住院医师10余名,以及博士、硕士研究生20余名,致力于各种妇科肿瘤及疑难病例的临床、教学及科研工作。
图片
 妇产科在线APP下载
妇产科在线APP下载













