抗磷脂综合征(anti-phospholipid syndrome, APS)是指由抗磷脂抗体(antiphospholipid antibodies,aPL)引起的一组临床征象的总称,主要表现为血栓形成、病态妊娠和血小板减少等。在同一患者可仅有上述一种表现,也可同时有多种表现。最主要的抗磷脂抗体包括抗心磷脂抗体(anticardiolipin,aCL)、狼疮抗凝物(lupus anticoagulant, LA)和抗β2糖蛋白I抗体(anti-β2 glycoprotein I,β2GPI)。
一、APS诊断标准的变迁和产科APS
Wilson 在1999年提出了APS的分类标准,Miyakis在2006年对定义做了修订。
1.临床标准
包括动、静脉血栓形成;≥10周以上的1次或多次不明原因形态正常胎儿死亡,1次或多次形态正常胎儿早产(特指34周之前由于子痫或重度子痫前期导致的胎盘机能不全),除外父母染色体异常的连续3次及3次以上不明原因<10周的自然流产;血小板减少。
2.实验室标准
包括抗心磷脂抗体、狼疮抗凝物和(或)抗β2糖蛋白I抗体至少发现2次阳性,2次间隔至少12周;对三种抗磷脂抗体的检测要求包括IgM/IgG-ACL(中、高水平) 阳性,LA阳性和IgM/IgG-β2GPI阳性 。
第13届国际抗磷脂抗体大会上提出了非标准抗磷脂抗体,包括抗凝血酶原/丝氨酸复合物抗体(anti-phosphatidylserine-prothrombin complex antibodies, aPT/PS)、抗膜联蛋白A5抗体(anti-annexin-A5 antibodies,aAXN5)、抗磷脂酰乙醇胺抗体(anti-phosphatidylethanolamine antibodies, aPE)、抗磷脂酰肌醇抗体、抗磷脂酰胆碱抗体和抗鞘磷脂抗体等。
在第14届国际抗磷脂抗体大会上提出了产科APS,临床标准包括早期复发性流产(<10周妊娠)、胎儿死亡(≥10周妊娠)、子痫前期和胎盘机能不全、不孕症和与APS产科不良结局相关的补体介导的炎症反应;实验室标准同前。Arachchillage等在2015年提出了非典型产科APS概念。
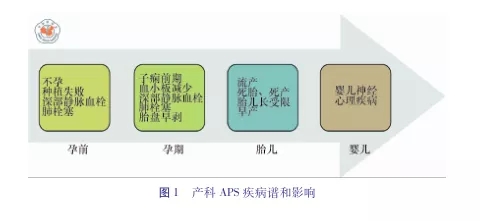
一项包括115例产科APS病例的研究中,其随访期间,12例(10.4%)发生血栓,其中9例为动脉血栓(血栓部位均为脑部),静脉血栓有3例(肺栓塞、卵巢静脉血栓和大腿近端深静脉血栓各1例),提示需要重视产科APS 的诊断和处理。在对产科APS应用肝素和阿司匹林治疗后, 患者(尤其是既往有血栓病史者)的相关并发症发生率仍然很高。3种抗体阳性患者中,治疗后获得活产儿的机会大致30%。除经典的血栓性胎盘因素外,其他因素包括炎症和补体激活也在并发症发生中起重要作用。图1为产科APS疾病谱和影响。
二、发病机制
产科APS的临床表现主要有子痫前期、胎儿生长受限和死胎等,其特征是绒毛外滋养细胞未能充分重建螺旋动脉,母体流入胎盘的血流减少、中断,导致胎盘缺氧、缺血、损伤,影响胎儿营养输送。
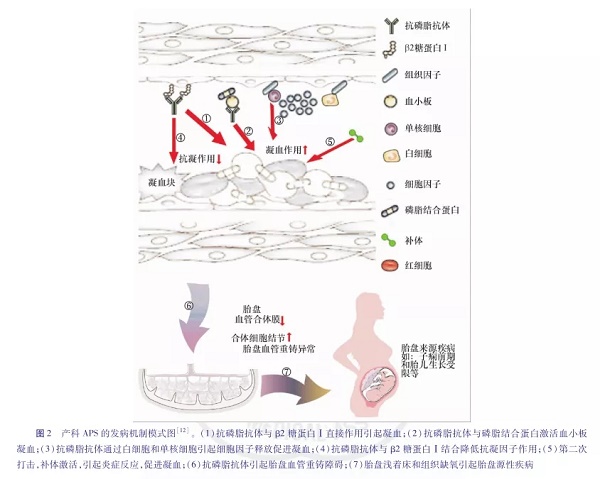
1.抗磷脂抗体引起血栓形成
(1)抗磷脂抗体与抗β2糖蛋白I抗体在细胞表面结合及内皮细胞相互作用,诱导促凝和炎症反应。
(2)抗磷脂抗体上调内皮细胞及单核细胞组织因子表达,促进内皮细胞黏附、细胞因子分泌及前列腺素E2合成。
(3)抗磷脂抗体识别血小板上表达的磷脂结合蛋白,增强血小板聚集。
(4)抗磷脂抗体通过抑制抗凝活性影响纤溶作用以及通过膜联蛋白A5作用,促进凝血及血栓形成。
凝血是APS发病的重要机制,凝血形成通常需要两个步骤:
(1)抗磷脂抗体存在形成“第一次打击”。
(2)当伴随有另一种促凝剂条件,即“第二次打击”时产生凝血。补体激活在凝血形成过程中起重要作用。
2.抗磷脂抗体引起胎盘发育异常
(1)抗磷脂抗体识别抗β2糖蛋白I抗体触发早孕绒毛外滋养细胞产生高水平促炎细胞因子(如干扰素和趋化因子),抑制滋养细胞自发迁移。
(2)增加滋养细胞抗血管生成可溶性类fms酪氨酸激酶-1(fms-like tyrosine kinase 1,Flt-1)分泌,抑制绒毛外滋养细胞的增殖和植入,滋养细胞重铸螺旋动脉缺陷,胎盘灌注不良,可溶性Flt-1和可溶性内皮素产生,可溶性Flt-1阻止血管内皮生长因子和胎盘生长因子与其受体结合,血管生成障碍。
(3)抗磷脂抗体抑制合体滋养细胞生长,导致合体滋养细胞死亡增加,人绒毛膜促性腺激素产生减少。
(4)抗磷脂抗体激活补体系统,导致抗血管生成因子释放而影响正常妊娠所需血管生成因子,导致产科APS。
抗磷脂抗体相关妊娠胎盘病理分析显示,胎盘与抗磷脂抗体相关的特征包括胎盘梗死,螺旋动脉重铸受损,蜕膜炎症,合体细胞结节增加和血管平滑肌细胞膜减少。图2为产科APS的发病机制。
三、临床表现
产科APS可作为原发疾病独立存在,也可与其他自身免疫疾病如系统性红斑狼疮(systemic lupus erythematosus, SLE)同时存在。在健康孕妇,3种抗磷脂抗体(尤其是抗心磷脂抗体或抗β2糖蛋白I抗体)中的一种或多种低滴度阳性率为5%,在SLE患者中,上述抗体阳性率高达40%。APS的产科表现如下。
1.早期复发性流产
早期复发性流产是指有3次或3次以上原因不明的妊娠<10周的胚胎丢失。15%早期复发性流产女性抗磷脂抗体阳性。尽管应用低分子肝素和低剂量阿司匹林给予治疗,典型的APS患者早期复发性流产在其下一次妊娠中仍占8.3%。妊娠丢失孕妇中,狼疮抗体、抗心磷脂抗体和抗β2 糖蛋白I抗体的阳性率依次为7%~12%、3%~16%和2%~8%。
2.死胎
死胎是指妊娠20周后胎儿在子宫内死亡。9.6%的妊娠≥20周死胎抗磷脂抗体阳性,活产对照中抗磷脂抗体阳性率为6%;其他原因不明死胎病例中,抗心磷脂抗体(IgG)和抗心磷脂抗体(IgM)及抗β2糖蛋白I抗体(IgG)阳性者死胎风险分别增加5倍、2倍和3倍;14%的原因未明死胎与APS相关,尽管给予治疗,典型的APS患者其下一次妊娠中死胎仍占15.9%。
3.胎盘功能不全
胎盘功能不全有4个表现,羊水少、胎儿生长受限、脐动脉血流舒张期断流和胎心监护异常。
4.子痫前期
子痫前期指发生在妊娠20周以后,出现血压升高伴有尿蛋白阳性,或虽无尿蛋白,但出现血小板减少、肝肾功能受损、肺水肿和新发的中枢神经系统异常或视觉障碍。7.9%的重度子痫前期患者抗磷脂抗体阳性,对照组抗磷脂抗体阳性率为0.5%;尽管给予治疗,典型的APS患者重度子痫前期在其下一次妊娠中仍占10%。重度子痫前期伴胎盘功能不全(表现为胎儿生长受限)常引起的34周之前早产,其与抗磷脂抗体阳性的关系尚未最终确定。胎盘功能不全的临床表现包括胎监异常、多普勒超声脐动脉血流异常,羊水过少和胎儿生长受限。
5.血栓形成
APS最常见的血栓是下肢深静脉血栓形成,约占血栓性APS病例的2/3。
6.血小板减少
血小板数在50×109/L~150×109/L为轻度血小板减少,小于50×109/L为重度血小板减少。
四、APS的特殊类型
1.难治性产科APS
难治性产科APS的诊断依据:
(1)典型产科APS。
(2)既往妊娠发生抗磷脂抗体相关的产科不良结局,在接受阿司匹林和低分子肝素联合治疗后,仍然发生妊娠丢失(早期流产、死胎)、先兆子痫或HELLP综合征及孕34周前的早产。
(3)在妊娠失败后再次妊娠。
2.非典型产科APS
(1)临床标准:
①2次不明原因的自然流产;
②3次非连续的自然流产;
③晚发型子痫前期;
④胎盘早剥或晚期早产;
⑤2次辅助生殖治疗失败。
(2)实验室标准:
①抗心磷脂抗体或抗β2糖蛋白I抗体低度阳性(第95~99百分位数);
②符合APS临床标准伴非连续抗磷脂抗体阳性。对妊娠发病妇女的临床观察和队列研究表明,非典型产科APS如未处理可能导致不良妊娠结局。
3.灾难性APS
灾难性APS未包括在国际诊断标准中,通常为1周内出现3个或更多器官的血栓形成,至少1个器官的微血栓形成和持续的抗磷脂抗体阳性。相关疾病包括小血管血栓形成、多器官功能障碍和全身炎症反应,涉及主要器官(如肾脏或肝脏),死亡率高。其他相关临床特征包括免疫性血小板减少症、溶血性贫血、心脏瓣膜病、慢性皮肤溃疡、脊髓病、舞蹈病、偏头痛、癫痫和认知障碍,可以与SLE并存。
五、APS的主要抗体及致病强度
APS发病相关的主要抗体包括狼疮抗凝物、抗心磷脂抗体和抗β2糖蛋白I抗体。新提出非标准抗磷脂抗体包括aPT/PS、aAXN5、aPE、抗磷脂酰肌酶抗体、抗磷脂酰胆碱抗体和抗鞘磷脂抗体等。以下简述主要抗体的检测及致病强度。
1.狼疮抗凝物
是一种IgG/IgM 型免疫球蛋白,作用于凝血酶原复合物(因子Xa、Va、Ca2及磷脂)以及Tenase复合体(因子Ⅸa、Ⅷa、Ca2及磷脂),检测狼疮抗凝物是一种功能试验,有凝血酶原时间、激活的部分凝血活酶时间、白陶土凝集时间和蛇毒试验,其中以白陶土凝集时间和蛇毒试验较敏感。
2.抗心磷脂抗抗体
目前标准化的检测是用酶联免疫吸附法,持续中高滴度的IgG/IgM型抗心磷脂抗体与血栓密切相关,IgG型抗心磷脂抗抗体与中晚期流产相关。抗心磷脂抗体分为两类,一类是非抗β2糖蛋白I抗体依赖性抗体,多见于感染性疾病;另外一类是抗β2糖蛋白I抗体依赖性抗体,多见于自身免疫病。
3.抗β2糖蛋白I抗体
抗β2糖蛋白I抗体具有狼疮抗凝物活性,用ELISA法检测,与血栓形成的相关性比抗心磷脂抗体强,假阳性低,诊断产科APS的敏感性与抗心磷脂抗抗体相仿。
APS特别是产科APS是新发现和定义的疾病,本病的疾病谱及相关检测抗体的种类及正常值仍然在不断探索中。大量的患者APL实验室指标不能达到中高滴度阳性(>第99百分位数),很多仅达到低滴度阳性(第95~99 百分位数)。
六、诊断和鉴别诊断
产科APS诊断的临床标准相对常见且非特异性,最终诊断取决于抗磷脂抗体阳性。诊断产科APS至少需要一个临床标准和抗磷脂抗体阳性,其中实验室诊断标准要求患者具有中等至高滴度的抗心磷脂抗抗体 IgG或IgM抗体、抗β2糖蛋白I抗体 IgG或IgM抗体或狼疮抗凝物。需要持续至少间隔12周的两次或更多次阳性的结果。抗体高滴度和多抗体阳性的诊断准确性更高。但妊娠妇女通常无法在治疗前等待12周确诊,在权衡风险和潜在益处后,对存在产科APS临床表现者,如果发现抗磷脂抗体阳性,可诊断非典型产科APS。
需要鉴别的疾病包括妊娠急性脂肪肝、HELLP综合征、溶血性尿毒症综合征、微血管病变溶血性贫血和血栓性血小板减少性紫癜等。妊娠合并血栓性微血管病变的鉴别诊断见表1。

七、治疗
产科APS的治疗目的为最小化或消除血栓形成、流产、死胎、子痫前期、胎盘功能不全和医源性早产风险。根据目前推荐的策略,诊断为APS女性成功妊娠(分娩一个活的婴儿)可能性超过70%。抗磷脂综合征妊娠已成为产科研究的一个重要领域,新的治疗方法亦不断出现。
1.肝素
肝素(包括普通肝素、低分子肝素)与抗凝血酶形成复合物,进而结合凝血酶以及相关的凝血因子,阻止凝血酶发挥凝血作用,抑制纤维蛋白生成,同时抑制V因子和Ⅷ因子活化。低分子肝素是普通肝素酶解或化学降解产物,分子量小,皮下注射低分子肝素对血小板影响小,生物利用度高,半衰期长,有更明显纤维蛋白溶解作用,通常无须常规监测凝血指标。同时,肝素能够抑制自然杀伤细胞毒性、防止抗磷脂抗体诱导滋养层炎症和滋养层细胞死亡、抑制补体活化、减少抗β2糖蛋白I抗体在组织的沉积和调节炎症反应等。
2.阿司匹林
阿司匹林通过阻断环氧化酶抑制血小板合成血栓素,从而抑制血小板聚集,避免形成血栓。阿司匹林通过抗血栓及增加白细胞介素-3分泌而改善子宫血流,促进胚胎着床和胎盘生长。
3.强的松
强的松为合成糖皮质激素,能够减少免疫反应和降低抗血小板抗体形成,能够抑制脾脏单核巨噬细胞吞噬附有抗体血小板的作用。强的松可抑制补体激活、降低自然杀伤细胞数量、上调人白细胞抗原(human leakocyte antigen,HLA)-C、HLA-E 和HLA-G表达,减轻母体和胎儿间炎症反应,主要用于难治性APS和难治性产科APS治疗。
4.丙种球蛋白
丙种球蛋白含人血清所具有的各种抗体,可增强机体免疫力。应用丙种球蛋白使低免疫或无免疫状态患者获得暂时免疫保护,主要用于难治性APS治疗。
5.羟氯喹
羟氯喹为抗疟药,具有抗炎、抑制免疫反应亢进、调节免疫反应、阻断炎症因子合成作用及抑制补体相关的抗原抗体反应作用。与抗血小板抗体的结合,使膜联蛋白A5恢复至正常水平,抑制和减少胎盘血栓形成。同时对磷脂与抗β2糖蛋白I抗体复合物结合直接影响,进一步减少胎盘血栓形成。羟氯喹对母亲和胎儿是安全的,也可以在哺乳期应用,主要用于难治性APS治疗。
6.其他药物
包括肿瘤坏死因子-α抑制剂(如阿达木单抗和依那西普、他汀类药如普伐他汀、利伐沙班、达比加仑等)尚处于研究中,可能对难治性APS和灾难性APS有一定治疗作用。
八、管理
1.妊娠期管理
由产科医生与风湿科专科医生评估和监测患者的风险及调整药物,避免应用有明显致畸作用的药物,避免在哺乳期用药。SLE女性孕前应控制病情稳定至少6个月以后再考虑妊娠。加强胎儿监测,包括超声监测和胎心电子监测。产科APS属于高危妊娠,患者容易出现胎盘功能不良,理想的终止妊娠时间尚不明确,有限的资料支持在妊娠39周后择期终止妊娠。
2.分娩期管理
在腰硬膜外麻醉前24 h停用低分子肝素的抗血栓治疗剂量,改用预防血栓剂量至麻醉前12 h。通常在6~8 h后可以恢复凝血功能。小剂量阿司匹林并不增加硬膜外腔血肿的风险。
3.产后处理
在分娩后6~8周内对有指征的患者继续使用小剂量阿司匹林+普通肝素或低分子肝素,肝素和华法令可以在哺乳期应用。没有血栓病史的产科APS患者,长期小剂量阿司匹林可能会降低初次血栓的风险。部分有指征的患者需要长期抗凝治疗。
综上所述,产科APS的基础治疗是小剂量阿司匹林+低分子肝素治疗, 难治性APS患者需用免疫球蛋白、类固醇激素,必要时进行血浆置换。对非典型产科APS的最佳治疗方案仍未确定。抗磷脂抗体介导的血栓事件不能解释所有产科APS临床表现,抗磷脂抗体引起胎盘病理改变可能参与疾病过程,众多问题尚需继续深入研究。
参考文献(略)
刘平, 樊尚荣. 产科抗磷脂综合征的诊断和治疗[J/CD]. 中华产科急救电子杂志, 2019, 8(2): 87-92.中华产科急救电子杂志2019年5月第8卷第2期 Chin J Obstet Emerg(Electronic Edition),May 2019, Vol.8, No.2
 妇产科在线APP下载
妇产科在线APP下载













