作者:谢俣 陈丽梅
单位:复旦大学附属妇产科医院宫颈及阴道早期疾病诊治中心
Breaking news

2022年4月11号,世界卫生组织(WHO)免疫战略咨询专家组(SAGE, Strategic Advisory Group of Experts) 发布最新消息,单剂人乳头瘤病毒 (HPV) 疫苗可提供针对HPV的可靠保护。SAGE专家组于4月4日至7日召开会议,评估了过去几年出现的证据,SAGE认为单剂次方案与两剂或三剂方案的疗效相当,建议各国现在可以为9~14岁的女孩和15~20岁的女性选择一剂或两剂方案。WHO强调,单剂HPV疫苗接种是朝着实现WHO加快消除宫颈癌全球战略迈出的重要一步。
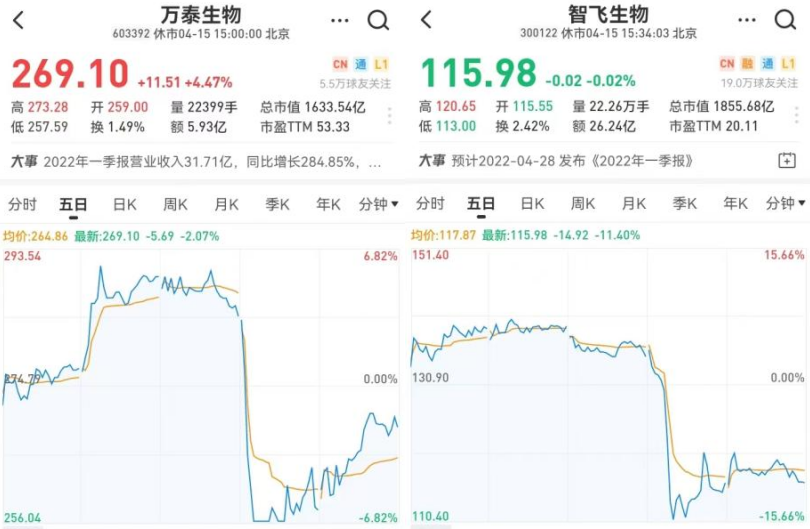
在消息公布后,国内HPV疫苗生产商万泰生物以及默沙东HPV疫苗代理商智飞生物股价应声下跌超十个点。
1. 世卫组织加快消除宫颈癌全球战略
2018年5月,WHO提出了全球消除宫颈癌的行动号召,明确提出了总体目标和2030年应达到的目标值。其中目标之一是2030年,让90%的女孩在15岁之前完成接种HPV疫苗。世卫组织助理总干事Nothemba Simelela博士认为,单剂次HPV疫苗接种建议有可能推动该目标更快实现。
在2022年4月之前,WHO建议为9~14岁的女孩接种两剂HPV疫苗,第2剂可在第一剂后6个月至3~5年灵活接种。15岁及以上的女孩和免疫功能低下的女孩(包括艾滋病毒感染者)应接种三剂。
自2006年第一个HPV疫苗问世至今,全球15岁以下女孩的疫苗覆盖率增长非常缓慢,2019年全球仅达到15%左右,2021年全球覆盖率仅为13%。这远低于WHO 2030年消除宫颈癌倡议的90%覆盖率目标。
大约90%的宫颈癌死亡发生在中低收入国家。中低收入国家的疫苗接种率比世界其他地区低40%。许多国家难以实现两剂HPV疫苗接种计划的高覆盖率,而自筹资金的国家则不愿引入相对昂贵的疫苗。近年来,HPV疫苗产能限制和新冠病毒大流行也是阻碍HPV疫苗推广的因素。
SAGE认为,单剂次HPV疫苗接种计划有可能加速尚未引入HPV疫苗的国家引入,并通过简化交付和降低计划成本促进这些国家推广HPV疫苗。这一新的SAGE建议可能有助于实现WHO的目标。
2. 单剂量HPV疫苗评估机构
单剂次HPV疫苗评估联盟(Single-Dose HPV Vaccine Evaluation Consortium),该联盟由PATH协调成立,包括哈佛大学、伦敦卫生与热带医学学院、拉瓦尔大学、英属哥伦比亚大学、美国疾病控制和预防中心、美国国家癌症研究所、Wits生殖健康和HIV研究所以及Kirby新南威尔士大学研究所。
在过去4年中,单剂次HPV疫苗评估联盟收集并评估了来自临床试验、观察性研究和模型分析的数据,这些数据涉及单剂次HPV疫苗接种计划的价值。
关于PATH
PATH是一家致力于消除健康领域的不平等,促进人与社区和经济体可持续发展的非营利组织,总部位于西雅图。PATH目前在全世界有超过70个国家开展工作。
追溯PATH的历史,该组织创立至今已有44年。作为政府和广泛的地方、国家和地区利益相关者的值得信赖的合作伙伴,PATH的团队为政府提供技术援助,致力于减轻传染病的负担,倡导公平,引入新技术和方法,以及为跨部门的合作伙伴提供以患者为中心的关爱和支持。
3. 单剂量HPV疫苗有效性证据
单剂次HPV疫苗评估联盟(Single-Dose HPV Vaccine Evaluation Consortium)在四月发布的最新单剂分析报告中阐述,截止到目前,从临床试验和观察性临床研究中积累的数据推断,单次接种HPV疫苗可以明显降低由HPV引起的宫颈癌前病变和癌症的发病率。单剂次带来了成本的大幅降低和简化实施,有助于更多国家引入HPV疫苗接种或增加覆盖率。健康和经济影响分析表明,单剂次HPV疫苗接种可能是一种高价值的公共卫生干预措施。
单剂次HPV疫苗接种评估联盟认为,虽然未来几年的其他临床试验和观察性研究数据预计将提供更多关于单剂次疫苗相对于多剂量方案的保护持续时间、疗效和有效性的信息,但目前的证据支持以下结论:单剂次二价(Cervarix®)、四价(Gardasil®)和九价(Gardasil®9)疫苗接种用于免疫能力强的女孩将提供与两剂疫苗相同或接近等效的保护。
在得出上述结论时,单剂次HPV疫苗接种评估联盟审查了几项单剂次HPV疫苗接种的功效、免疫原性和有效性的临床试验证据。以下是所有此类研究的摘要和参考文献以及公开数据。此外,该联盟还审查并评估了一些观察性研究和建模分析的关于单剂次HPV疫苗接种的证据。
KEN-SHE,肯尼亚(功效研究)
(1) 研究概述:
对15~20岁女性进行单剂HPV疫苗接种的前瞻性、盲法、随机研究[1]。
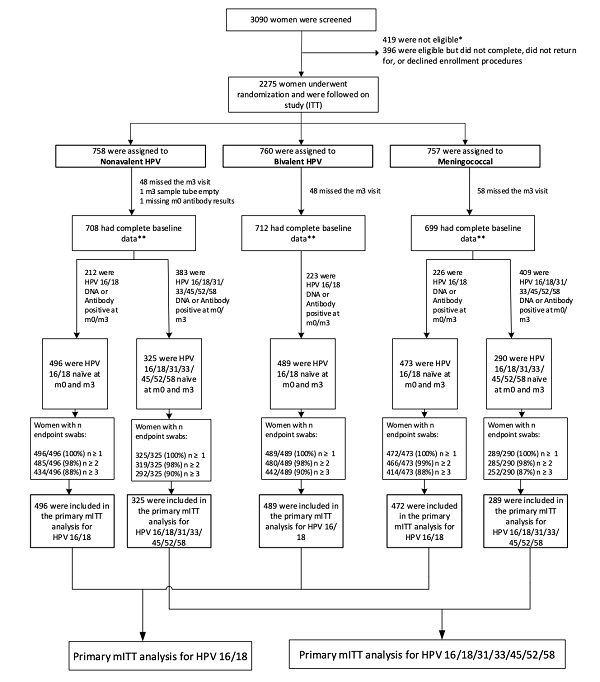
(2)研究分组:
2250例受试者被随机分配到三组:二价(Cervarix®)、九价 (Gardasil® 9)、延迟接种(接种脑膜炎球菌疫苗)。
(3)研究持续时间:
已获得第18个月的分析数据;随访将继续进行,持续至第36个月。
(4) 研究目标:
• 与延迟接种疫苗相比,使用单剂量Cervarix或Gardasil 9 HPV疫苗接种在预防持续性HPV感染方面的疫苗效力;
• 桥接与对比-剂量减少免疫桥接和安全性研究(Dose-Reduction Immunobridging and Safety Study, DoRIS,9~14岁女性)的24个月免疫原性数据。
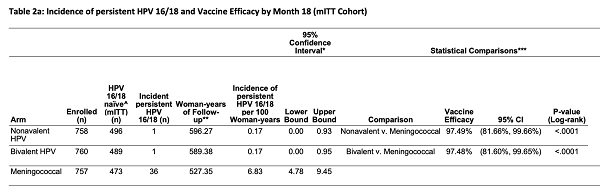
(5)第 18个月的结果摘要[2]:
• 单剂Cervarix 和Gardasil 9疫苗在预防非洲少女和年轻女性发生持续性致癌HPV感染方面非常有效。两种疫苗在第18个月对HPV-16/18持续感染的疫苗效力为97.5%。
• 该作者仅进行了单剂疫苗的保护效力研究,进而在讨论中将单剂疫苗的数据与已发表的两篇文献(Joura et al. NEJM. 2015)、(Harper et al. Lancet.2014)数据进行了对比, 作者认为单剂疗效估计与多剂量方案报告的相似。
DoRIS,坦桑尼亚(免疫原性研究)
(1)研究概述:
9~14岁女性的随机非盲、开放标签试验[3]。
(2)研究分组:
930例受试者随机分为6组,接种1、2、3针二价Cervarix 或Gardasil 9价疫苗。
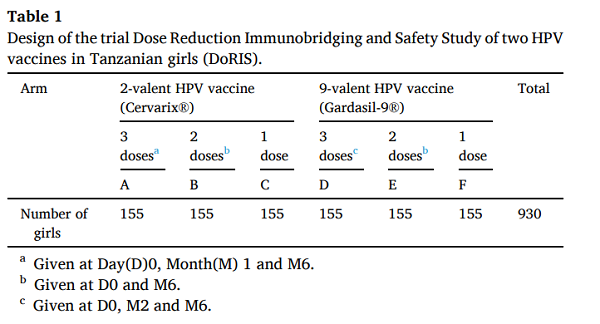
(3)研究持续时间:
提供第24个月的数据;免疫持续性随访至第60个月。
(4)研究目标:
• 24个月的免疫非劣效性1剂与2~3剂(血清阳性);
• 24个月的免疫非劣效性1剂与历史对照10~25岁 (GMTs)(免疫桥接至哥斯达黎加疫苗试验 [CVT],印度 IARC)。
(5)第24个月的结果摘要:
• 与历史队列CVT对比,单剂Cervarix不劣于之前单剂数据;
• 与历史队列India-IARC对比,单剂量Gardasil不劣于之前单剂数据 (编者注:这个结果摘要为2021年11月的国际乳头瘤病毒会议IPVC摘要,会议摘要中的目标是对比1剂与2~3剂,但结论未见1剂与2~3剂的对比。该研究目前未见公开文献发表,未见详细数据)。
IARC,印度(功效研究)
(1) 研究概述:
研究参与者为10~18岁的女性,参加一项2009年至2010年随机临床试验,比较了四价Gardasil的2针和3针方案,对疗效和免疫原性进行了随访。
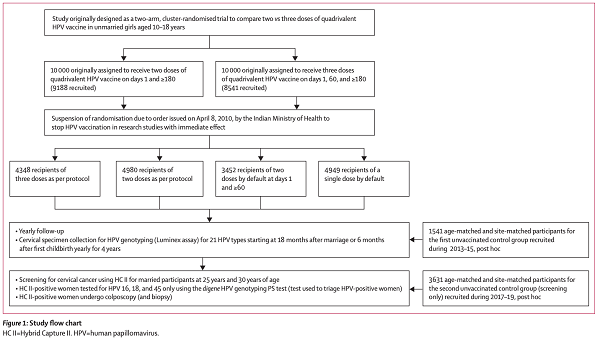
(2)研究人群:
在入组后,分为四个亚组,三针为(0、2、6方案),两针为(0、6方案)和(0、2方案),分别纳入,还有一组受试者因与研究无关的原因中断后仅接受单剂疫苗,作为单剂组。4348例受试者接种了三剂,4980例接种了两剂(0个月和 6 个月),3452例受试者接种了(0、2方案)两剂疫苗,4949例接种了单剂。
(3)研究持续时间:
已获得10年疗效和免疫原性数据;随访将持续至疫苗接种后15年。
(4)研究目标:
• 四价HPV疫苗接种在预防持续性HPV-16/18感染方面的功效。
(5)第10年原始数据:
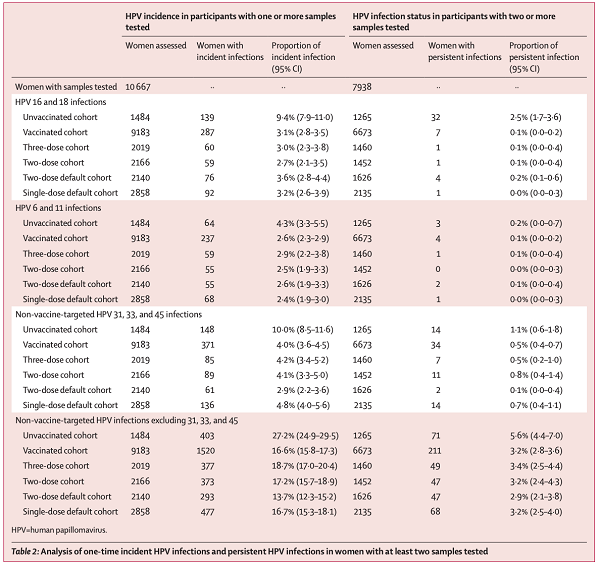
从表中可以看到,亚组中,纳入的评估人群分析,四种不同的接种方案,针对HPV16/18型、6/11型,甚至四价未覆盖的31/33/45亚型和非31/33/45亚型,提供的保护效力大致相同。
下图针对其中三种亚组(单剂、两剂0、6方案和0、2、6个月的三剂)的分析,可以同样观察到相同保护效力的现象。
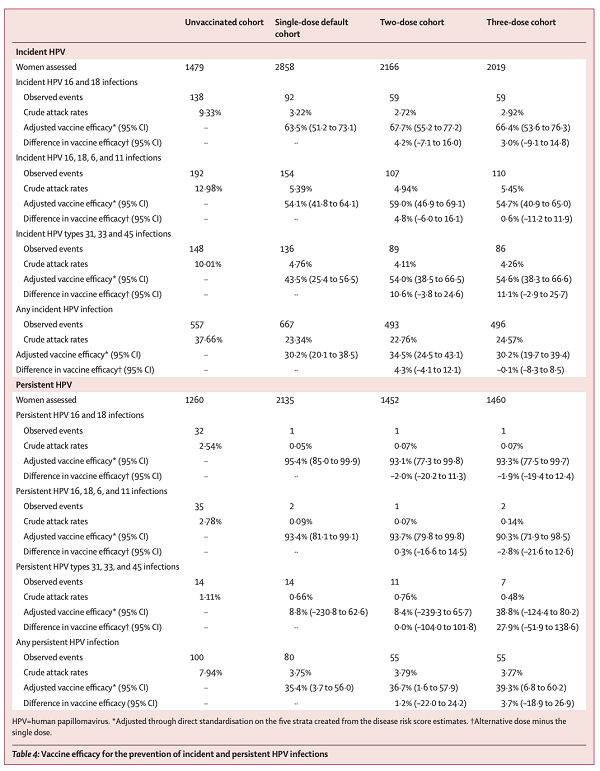
(2)6第10年的结果总结[4]:
• 在不同的计划中(单剂、两剂0、6方案和0、2、6个月的三剂)Gardasil病毒学终点中,三种方案中,都提供相似的超过90%的抗HPV-16/18有效率,且疫苗接种后至少保护10年。
HPV疫苗试验,哥斯达黎加(功效/免疫原性研究)
(1)研究概述:
随访研究参与者于2004至2005参加的一项随机临床试验,比较二价 Cervarix的3种剂量方案。主要分析的是疫苗接种后第9年和第11年的数据。
值得注意的是,其原始研究是4年随访的二价HPV疫苗和接受安慰剂(甲肝疫苗Havrix)的对比。但是试验中,接受HPV疫苗的试验组中大约20%的女性接受了少于三剂的指定疫苗 。缺少疫苗剂量的原因与试验组无关,主要是由于怀孕和阴道镜转诊,但是这部分数据同样随访,所以为分析不同剂量提供了宝贵的数据。
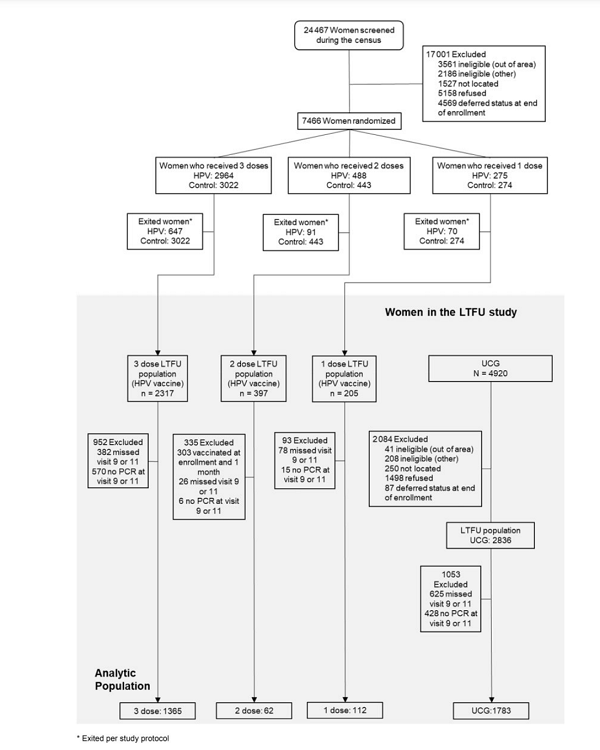
(2)研究分组:
7466例18~25岁的女性参与研究;275例参与者接受了单剂二价HPV疫苗,最终接受单剂HPV受试者中纳入研究112例。
(3)研究目标:
• HPV疫苗接种十多年后,二价HPV疫苗接种在预防HPV-16/18感染有效;
• 疫苗接种后抗体反应的持续时间长达20年。
(4)原始数据:
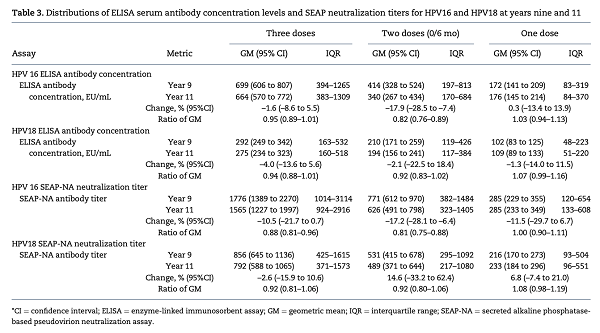
从上表的数据可以看到,无论HPV16型还是18型,血清抗体滴度都是从三剂到单剂递减,且倍数差异都比较明显,例如16型ELISA抗体监测方法,在第9年随访时,三剂为699 EU/mL,两剂为414 EU/mL,单剂为172 EU/mL。但是这仅仅是抗体滴度。
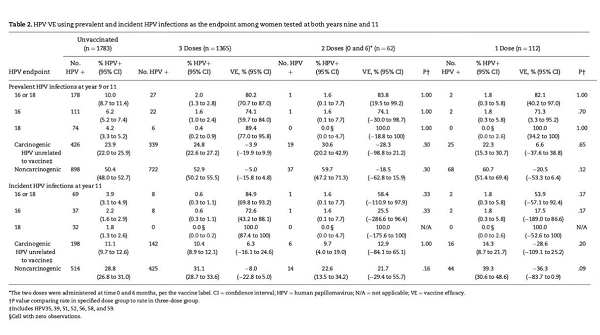
我们再来看另外一个表格,从下表中我们可以看到针对HPV病毒感染终点来判断疫苗的保护效力,针对16或18型HPV感染,无论单剂、两剂还是三剂在接种后第9年和第11年都提供相似的保护效力,都显著好于未接种组。
(5)结果总结[5]:
• 所有受试者中HPV-16和HPV-18抗体在Cervarix单剂量给药后持续数倍于自然感染,长达11年;
• 对HPV16/18感染的疗效,单剂二价Cervarix与多剂方案相似,尽管受试者数量很少。
4. 单剂量HPV疫苗有效性模型研究[6~9]
美国国立卫生研究院(NIH)国家癌症研究所的Aimée R Kreimer博士等发现HPV疫苗不同剂次接种组的中位随访时间为11.3年,病毒学终点中针对流行的HPV16或18感染在三剂中为80.2%,在两剂中为 83.8%和在单剂次女性中82.1%。HPV16或18抗体水平在第4年和第11年之间没有出现质量下降,无论给予多少剂量,但是与两剂和三剂相比,一剂滴度在统计学上仍然显着降低。他们得出的结论是HPV疫苗接种十多年后,针对HPV16或18感染的单剂次病毒学终点(VE)仍然很高,HPV16或18抗体保持稳定。单剂次的二价HPV疫苗可能会产生足够持久的保护,从而无需更多剂量[5]。
伦敦卫生与热带医学学院的Keisha prem等人通过比较模型分析综合了三个已发布的动态模型的结果,这些模型针对具有不同流行病学和人口统计特征的国家进行了校准,首次提供了关于常规单剂方案潜在全球影响的证据。他们在所有模型中发现一致的结果表明,如果单剂疫苗可提供超过20年的全部潜在功效或80%的终生功效,则常规一剂疫苗可为两剂计划提供大部分健康益处保护。他们的结论是:通过三个一致独立模型的结果,表明一剂疫苗与两剂疫苗具有相似的健康益处,同时简化了疫苗的交付、降低了成本并缓解了疫苗供应限制[6]。
哈佛公共卫生学院健康决策科学中心的Emily burger等人发现,对9 岁女孩进行常规一剂 HPV 疫苗接种需要大量的前期投资,但考虑到避免未来癌症的成本补偿,与不接种疫苗相比可以节省成本。在开始常规疫苗接种40年后,根据疫苗减量的假设,具有同等覆盖率 (70%) 的一剂 HPV 疫苗可避免 15~16%的宫颈癌病例,而两剂疫苗可避免 21%的宫颈癌病例,但只需要一半的前期经济投入。他们的结论是:与不接种疫苗相比,一剂HPV疫苗接种可节省成本,如果保护是长期的,可以实现更高的覆盖率,则与两剂疫苗相比可能具有成本效益[7]。
哈佛公共卫生学院健康决策科学中心的JANE J. KIM等人发现,尽管存在局限性,初步分析提供了几个重要的见解。首先,与单剂HPV 疫苗接种相关的绝对人群水平的益处是巨大的,即使效力和持久性低于两剂疫苗接种。其次,如果单剂疫苗接种计划能够实现更高的覆盖率,则可能能够弥补疫苗效力和耐久性的降低,这取决于疫苗效力是否以及如何减弱。鉴于尚未采用HPV疫苗接种计划的国家数量众多——再加上其固有的成本更低和更大的可行性——单剂HPV疫苗接种有可能在全球范围内提高HPV疫苗的影响[9]。
单剂次HPV疫苗评估联盟(Single-Dose HPV Vaccine Evaluation Consortium)综合模型[6-9]评估认为:对于宫颈癌预防,2剂方案仅比单剂方案保护的病例只是略多。目前的方法(常规接种2剂方案且没有多年龄组)预防的病例更少,效率较低且较不公平。立即实施单剂次HPV疫苗接种计划,这将比延迟实施等待正在进行的临床试验获得有关疫苗功效的更确凿证据,带来更大的健康益处[10]。
5. WHO最新关于HPV疫苗接种的建议
·针对9~14岁女孩的一剂或两剂接种;
·15~20岁年轻女性的一剂或两剂接种;
·对于21岁以上的女性,间隔6个月接种两次。
免疫功能低下的个体,包括HIV感染者,在可行的情况下,应接种三剂。如条件不允许,则至少接种两剂。关于该群体的单剂量疗效的证据有限。
SAGE主席Alejandro Cravioto博士评论道:“SAGE敦促所有国家引入HPV疫苗,并优先考虑多年龄群体和年龄较大的女性群体补接种疫苗。这些建议将使更多的女孩和女性能够接种疫苗,从而预防她们在一生中患上宫颈癌及其所有后果。”
目前,该接种建议为世界卫生组织(WHO)免疫战略咨询专家组(SAGE, Strategic Advisory Group of Experts)的评估会议后推荐,WHO的指南更新将在与相关组织及利益相关方进一步协商后更新。
从现有研究数据看,除了卫生经济学更优,单剂接种可能还有利于提升HPV疫苗接种覆盖率,尽早实现消除宫颈癌的战略目标;然而,最终HPV疫苗接种几剂更好,还需要更长时间,对HPV疫苗的安全性、保护效果进行观察。
(本文经复旦大学附属妇产科医院隋龙教授审阅)
参考文献:
1. Barnabas RV, Brown ER, Onono M, et al. Single-dose HPV vaccination efficacy among adolescent girls and young women in Kenya (the KEN SHE Study): study protocol for a randomized controlled trial. Trials. 2021; 22(1): 661-661. doi:10.1186/s13063-021-05608-8
2. Barnabas RV BE, Onono M, et al. Efficacy of single-dose HPV vaccination among young African women. Research Square. 2021 Nov 19; doi:10.21203/rs.3.rs-1090565/v1
3. Baisley KJ, Whitworth HS, Changalucha J, et al. A dose-reduction HPV vaccine immunobridging trial of two HPV vaccines among adolescent girls in Tanzania (the DoRIS trial) – Study protocol for a randomised controlled trial. Contemporary Clinical Trials. 2021/02/01/ 2021; 101: 106266. doi: https://doi.org/10.1016/j.cct.2021.106266
4. Basu P, Malvi SG, Joshi S, et al. Vaccine efficacy against persistent human papillomavirus (HPV) 16/18 infection at 10 years after one, two, and three doses of quadrivalent HPV vaccine in girls in India: a multicentre, prospective, cohort study. Lancet Oncol. 2021; 22(11): 1518-1529. doi:10.1016/S1470-2045(21)00453-8
5. Kreimer AR, Sampson JN, Porras C, et al. Evaluation of Durability of a Single Dose of the Bivalent HPV Vaccine: The CVT Trial. J Natl Cancer Inst. 2020; 112(10): 1038-1046. doi:10.1093/jnci/djaa011
6. Prem K, Choi YH, Bénard É, et al. Global impact and cost-effectiveness of one-dose versus two-dose human papillomavirus vaccination schedules: a comparative modelling analysis. medRxiv. 2021: 2021. 02. 08. 21251186. doi:10.1101/2021.02.08.21251186
7. Burger EA, Campos NG, Sy S, Regan C, Kim JJ. Health and economic benefits of single-dose HPV vaccination in a Gavi-eligible country. Vaccine. 2018/08// 2018; 36 (32 Pt A): 4823-4829. doi:10.1016/j.vaccine.2018.04.061
8. Drolet M, Laprise J-F, Martin D, et al. Optimal human papillomavirus vaccination strategies to prevent cervical cancer in low-income and middle-income countries in the context of limited resources: a mathematical modelling analysis. Lancet Infect Dis. 2021; 21(11): 1598-1610. doi:10.1016/S1473-3099(20)30860-4
9. KIM JJ. One dose: a great public health intervention? HPV World.
10.Single-Dose HPV Vaccine Evaluation Consortium,April 6, 2022, Current state of evidence on single-dose HPV vaccination and its implications for policy
专家简介

陈丽梅教授
医学博士,复旦大学附属妇产科医院宫颈疾病诊治中心副主任医师,新西兰奥克兰大学访问学者,长三角宫颈癌及女性下生殖道感染防控联盟秘书,上海市妇幼保健协会阴道镜宫颈病理专委会(SHSCCP)委员,中国医疗保健国际交流促进会妇产科分会青年委员,中国优生优育委员会妇科肿瘤专委会委员,《中国计划生育和妇产科》编委会委员。曾被评为复旦大学十大优秀青年医师。参译本专业领域权威论著《现代阴道镜学》《宫颈与下生殖道癌前病变诊断和治疗》,参编人民卫生出版社出版《实用阴道镜技术》《预防子宫颈癌百问百答—疫苗筛查治疗》。作为负责人主持国家自然科学基金并参与多项上海市课题,以第一作者发表专业SCI及核心论文20余篇。

谢俣博士
复旦大学附属妇产科医院博士研究生在读,导师为隋龙教授,硕士毕业于香港中文大学。
 妇产科在线APP下载
妇产科在线APP下载













