山东大学齐鲁医院超声科李杰教授团队在国际控制释放学会(Controlled Release Society)的官方杂志Journal of Controlled Release (中科院1区,IF=9.776)发表题为“Dual-responsive nanodroplets combined with ultrasound-targeted microbubble destruction suppress tumor growth and metastasis via autophagy blockade”(双重响应的纳米液滴与超声靶向微泡破坏联合通过自噬阻断来抑制肿瘤的生长和转移)的研究论文,报道了超声纳米微泡联合自噬阻断治疗在抑制肿瘤生长和转移方面的应用。该研究构建了双重响应性的超声纳米液滴,证实了该纳米液滴能够通过超声靶向微泡破坏(UTMD)严重破坏细胞稳态,激活细胞的保护性自噬,与自噬阻断治疗联合起到明显抑制肿瘤生长及转移的作用,为肿瘤的超声纳米联合治疗提供了新的思路。山东大学齐鲁医院为该论文的第一作者和通讯作者单位,李杰教授为该论文的通讯作者,硕士研究生王潇旋为该论文的第一作者。

肿瘤的生长和转移严重威胁人类的健康,其复杂性、多样性与异质性严重削弱了单一治疗模式的治疗效果。且目前多数靶向药物递送系统只具有单一的靶向药物递送功能,不具备分子成像等可视化功能。超声作为一种常用的物理诊断和治疗手段,具有无创、低成本、安全、非侵入性等优势。近年来的研究发现,超声具有除了机械效应与热效应之外的其他生物学效应,对肿瘤治疗带来新的思路与方向。李杰教授团队长期致力于设计兼具分子显像与靶向治疗的诊疗一体化纳米系统,并研究超声靶向微泡破裂技术相关参数所产生生物学效应的影响等。
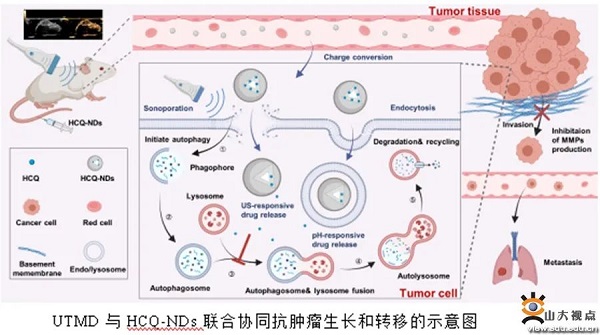
本研究以内源性pH响应的羧甲基壳聚糖为外壳,具备超声成像能力的液态氟碳为核心,制备负载自噬抑制剂的纳米液滴。这种纳米液滴具备肿瘤高靶向、长滞留、药物控释以及对比超声成像的能力。研究证实了该载药纳滴联合超声治疗对细胞自噬的作用是“激活后阻断”,能够有效地抑制小鼠4T1肿瘤的生长及转移,并进一步探究了其抑制肿瘤转移的机制(首次发现与基质金属蛋白酶2、基质金属蛋白酶9的表达下降有关)。上述研究工作获得了国家自然科学基金面上项目的资助。
近年来,在李杰教授的指导下,课题组着眼于构建精准医疗下靶向性纳米超声造影剂的肿瘤诊疗一体化系统,对纳米级超声造影剂的优化制备、靶向性分子探针修饰的设计研发、可视化精准诊疗、低机械指数下肿瘤的超声造影增强特点等进行了深入的基础和临床研究。课题组在肿瘤精准分子影像、肿瘤可视化治疗及疗效评估方面取得了多个重要成果,已授权相关国家发明专利近10项,发表相关论文三十余篇,制定专家共识1项,协助超声科成功申报国自然与省自然基金等科研项目,并成立了山东大学分子影像与超声医学研究中心,研究成果多次在国内外超声医学大会上报告,产生了广泛影响。
 妇产科在线APP下载
妇产科在线APP下载









 京公网安备 11010202008857号
京公网安备 11010202008857号