遗传性肿瘤是指一类由特定基因胚系变异引起、常以孟德尔遗传方式传递的肿瘤,包括单基因遗传性肿瘤和多基因遗传性肿瘤,占每年新发肿瘤的5%~10%。遗传咨询可对肿瘤的发生、发展起到重要的预警作用。近期,我国学者制定发布了《妇科肿瘤遗传咨询专家共识(2023年版)》。现将《妇科肿瘤遗传咨询专家共识(2023年版)》要点整理如下。
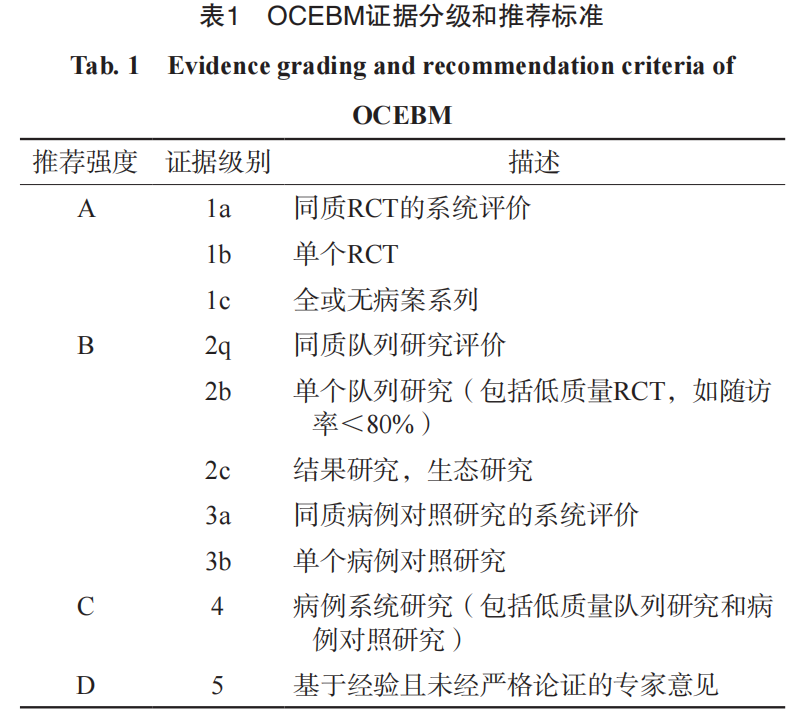
该共识采用牛津大学循证医学中心(OCEBM)证据分级系统,给出推荐强度A~D(表1)。
1、常见的遗传性妇科肿瘤综合征(HGCS)
HGCS表现多样,与散发性妇科肿瘤不同。遗传性肿瘤通常具有以下特征:① 发病年龄相对于该肿瘤的平均发病年龄显著提前;② 存在多种原发性肿瘤;③ 成对器官中双侧罹患肿瘤或存在多个肿瘤病灶;④ 亲属有同种肿瘤的聚集性发病;⑤ 家庭的多代人均罹患肿瘤(即常染色体显性遗传);⑥ 不完全外显性。
常见的HGCS为遗传性乳腺癌-卵巢癌综合征(HBOCS)和林奇综合征(LS)。此外HGCS还包括Cowden综合征(CS)、黑斑息肉综合征[又称波伊茨-耶格综合征(PJS)]、遗传性平滑肌瘤病和肾细胞癌(HLRCC)、DICER1综合征、横纹肌样肿瘤易感综合征(RTPS)等。
1.1 HBOCS
HBOCS是常见的HGCS之一,为常染色体显性遗传肿瘤综合征。80%~90%的HBOCS由BRCA1和BRCA2的胚系致病性变异引起。普通人群携带此类变异的概率约为1/200。HBOCS与多种肿瘤的发生风险升高有关,除乳腺癌、卵巢癌、输卵管癌及原发性腹膜癌外,还包括黑色素瘤、胰腺癌及前列腺癌。
当患者具有以下临床特征时,医师需要警惕,应仔细询问病史并推荐患者进行基因检测:① 肿瘤发病年龄早,在45岁左右或更早年龄发病;② 同时患有乳腺癌和卵巢癌;③ 有多个患癌的亲属。
1.2 LS
LS又称为遗传性非息肉病性结直肠癌(HNPCC),是一种由DNA错配修复(MMR)基因胚系致病性变异引起的HGCS。这些变异使相应的MMR蛋白丢失或影响其功能,导致微卫星不稳定性(MSI),增加细胞癌变的风险,进而导致肿瘤的发生。
LS的主要致病基因包括MLH1、PMS2、MSH2及MSH6等MMR基因,以及非MMR基因EPCAM。90%以上的LS存在MSI,但一些散发的结直肠癌和子宫内膜癌也存在MSI,多与MLH1启动子甲基化相关。
1.3 PJS
PJS是一种罕见的常染色体显性遗传病,其特征性表现为胃肠道错构瘤性息肉、皮肤黏膜色素沉着及发生多种肿瘤的倾向。PJS患者中约95%会出现黏膜皮肤色素沉着,但这种色素沉着会随着年龄增长而消失。PJS的患病率为1/200 000~1/50 000。
临床上,当具有以下两种或多种特征时,可以作出PJS的临床诊断:① 胃肠道(主要是小肠)内有两个或多个PJS型胃肠道错构瘤性息肉;② 口腔、嘴唇、鼻子、眼睛、生殖器或手指的黏膜皮肤色素沉着;③ PJS家族史。建议对符合上述标准或有PJS家族病史的任何患者进行遗传咨询和基因检测(STK11胚系变异)。
1.4 CS
CS是一种常染色体显性遗传疾病,其发病率约为1/200 000,与乳腺癌和子宫内膜癌的发生风险增加有关。PTEN基因变异携带者终生罹患乳腺癌的风险为77%~85%,终生患子宫内膜癌的风险为19%~28%(常发生在30~49岁)。CS相关的青少年子宫内膜癌的病例也有报道,因此有人建议对患有子宫内膜癌的青少年患者常规进行PTEN基因检测。
1.5 HLRCC
HLRCC又称为Reed综合征,与延胡索酸水合酶(FH)基因胚系变异相关,呈家族聚集性,90%~100%的家族成员可受到影响。患者常表现为皮肤平滑肌瘤(75%)或子宫平滑肌瘤(80%~90%),两者可单独发生或同时发生,部分并发肾细胞癌(2%~43%)。该病发生于年轻女性,药物及手术治疗是皮肤平滑肌瘤和子宫平滑肌瘤的常见治疗方法。
1.6 DICER1综合征
DICER1综合征是由DICER1胚系变异引起的常染色体显性遗传疾病。在普通人群中每10600人中有1例DICER1胚系变异。该病的常见肿瘤是胸膜肺母细胞瘤(PPB),通常出现在6岁以下的婴儿和儿童中。除PPB外,DICER1变异携带者还可发生其他几种特征性肿瘤,包括囊性肾瘤、横纹肌肉瘤、多结节性甲状腺肿和甲状腺癌,这些肿瘤通常在儿童期发病,而在妇科常发生的是卵巢Sertoli-Leydig细胞瘤(SLCT)。
1.7 RTPS
RTPS是一类罕见的恶性肿瘤,通常发生在3岁以下的婴幼儿中,常存在SMARCB1或SMARCA4致病性胚系变异。横纹肌样瘤(RT)可来源于中枢神经系统(65%)、肾脏(9%),其余26%的病例源自头颈部软组织、椎旁肌肉、肝脏、膀胱、纵隔、腹膜后和骨盆。涉及中枢神经系统的RTPS被称为非典型畸胎瘤(AT)/RT,高达50%的病例发生在小脑。SMARCA4胚系变异患者在妇科常发生的肿瘤是卵巢高钙血型小细胞癌(SCCOHT)。
2、肿瘤遗传咨询的适用群体
基于基因变异检测的人群(无论是否有家族史)筛查是一项受推荐的公共卫生策略,尤其是针对HBOCS及LS的人群筛查。重点关注以下情况。
(1)个人或亲属具有乳腺癌、卵巢癌、子宫内膜癌、结直肠癌、前列腺癌、肾癌和神经内分泌肿瘤等遗传性肿瘤的临床特征。
(2)已知遗传性肿瘤相关基因致病性/可能致病性(P/LP)状态的携带者。
(3)需要不影响生理需求和保留生育功能的所有罹患恶性肿瘤的年轻患者。
专家共识1:接受遗传性肿瘤筛查或检测的个体应该得到专业的遗传咨询(推荐强度:D)。
3、肿瘤遗传咨询的开展模式
专家共识2:肿瘤遗传咨询的模式,除了传统的面对面咨询外,还可以通过电话、视频咨询,提倡嵌入式和多学科协作模式(推荐强度:D)。
4、遗传性肿瘤遗传咨询流程
当为肿瘤患者提供基因检测时,强烈建议进行肿瘤风险评估和遗传咨询,包括检测前咨询和检测后咨询。
4.1 检测前遗传咨询的重点和注意事项
专家共识3:基因检测前遗传咨询内容包括评估咨询者的目的和需求,收集个人史及家族史,评估肿瘤遗传模式及遗传风险,讨论基因检测方案,并告知可能的检测结果、获益和风险及局限性,获取知情同意(推荐强度:B)。
4.2 检测后遗传咨询的重点和注意事项
专家共识4:① 为遗传性肿瘤患者制订个体化治疗方案、肿瘤风险管理方案及随访计划,对高风险亲属进行相关肿瘤遗传风险的告知和检测(推荐强度:B)。② 对育龄期遗传性肿瘤患者及携带者家系提供生育力保护和生殖健康的咨询和帮助(推荐强度:C)。③ 临床意义未明变异(VUS)不能作为改变临床决策的依据(推荐强度:C)。
5、遗传性肿瘤的检测方法及报告解读
5.1 遗传性肿瘤常用的检测方法
胚系基因变异检测是遗传性肿瘤诊断的“金标准”,通常使用血液样本作为胚系DNA提取材料。血液样本应使用一次性抗凝试管采集,推荐使用乙二胺四乙酸(EDTA)抗凝管。唾液及口腔拭子等样本也可用于胚系基因变异检测。对于疑似遗传性肿瘤先证者,出于潜在靶向治疗需要,如卵巢癌患者拟接受PARP抑制剂治疗,可考虑先以肿瘤组织进行基因变异检测,再在血液等正常组织中验证是否为胚系变异。
常见的检测技术包含(1)Sanger测序、(2)二代测序(NGS)技术、(3)全外显子组测序(WES)、(4)全基因组测序(WGS)、(5)候选变异位点的检测、(6)遗传性肿瘤的分子遗传学筛查、(7)综合性肿瘤分子病理学检查。
5.2 基因检测方法的选择
专家共识5:遗传性肿瘤基因检测应选择资质齐全、流程规范的实验室;先证者首选检测方法为靶向基因NGS和MLPA(补充检测),罕见或未知遗传性肿瘤可选择WES或WGS,致病变异明确的家系检测选用Sanger测序(推荐强度:B)。
5.3 基因检测报告解读原则
基因检测报告根据检出的变异是否可以解释送检指征,通常有4种结果:阳性(positive)、阴性(negative)、不确定(inconclusive)和携带者(carrier)。
5.3.1 阳性结果的遗传咨询
专家共识6:① 阳性基因检测结果不仅可以对受检者有针对性地筛查肿瘤、降低风险和给予治疗,也可影响直系亲属的肿瘤风险评估和基因检测建议,并指导受检者和家庭成员的生育计划(推荐强度:B)。② 建议定期随访阳性检测结果受检者,并再次提供遗传咨询,随访频率可因受检者的年龄、生育计划、合并症、风险降低手术和其他风险因素而异(推荐强度:B)。
5.3.2 阴性结果的遗传咨询
专家共识7:① 基因检测的阴性结果需考虑所选择检测方法和范围的局限性(推荐强度:B)。② 对于有家族肿瘤病史的阴性检测结果受检者,根据家族史仍然可以考虑增加肿瘤筛查和风险降低措施(推荐强度:D)。
5.3.3 不确定结果的遗传咨询
专家共识8:① 建议通过ClinGen SVI贝叶斯变异变异解读模型定量评估VUS(推荐强度:B)。② 10%~20%的VUS可重新分类为P/LP,建议根据VUS现有证据分类重新评估VUS升级为P/LP的潜力,建议根据变异重评估触发条件,启动触发性重评估(推荐强度:B)。③ 如果变异重分类变化将影响临床决策,建议检测机构及时更新报告(推荐强度:B)。
5.3.4 携带者结果的遗传咨询
专家共识9:① 肿瘤易感基因携带者结果的解读和咨询,需要综合考虑个体病史、家族病史、体格检查及其他相关信息(推荐强度:B)。② (疑似)遗传性肿瘤患者和家族成员,应考虑选择有针对性的基因检测方案,以充分评估个体和家族肿瘤遗传病因(推荐强度:B)。
6、妇科肿瘤遗传咨询的内容
6.1 遗传性肿瘤的患病风险评估
6.1.1 常见妇科肿瘤综合征的患癌风险评估
(1)HBOCS的女性携带者患卵巢癌的终生累积风险(至75岁),BRCA1为39%~58%,BRCA2为13%~29%。
(2)LS与卵巢癌、子宫内膜癌的风险均相关。LS的女性携带者中,子宫内膜癌是继结肠癌之后较为常见的肿瘤类型,其终生累积风险根据变异的基因不同,可能为21%~71%。卵巢癌的终生累积风险为6%~12%。
(3)PJS:女性PJS患者的卵巢癌、子宫内膜癌和宫颈癌的风险分别为18%~21%、9%和10%。
(4)CS女性携带者患子宫内膜癌的终生累积风险为19%~28%。
6.1.2 评估需要关注的情况
(1)是否已经有高质量数据明确该基因变异的癌症风险增高。
(2)全面采集评估个人病史。
(3)详细采集家族病史,包括癌症类型和发病年龄。
(4)如果是明确的高风险基因变异(如BRCA1/2),需要注意终生患癌的累积风险的年龄上限。
(5)根据个人病史和家庭病史,给出更为个体化的风险数据。
6.1.3 风险评估中的考量因素
(1)是否明确肿瘤综合征中的特定基因。
(2)是否存在基因变异特异性导致的癌症风险差异。
(3)特定年龄段的癌症发生风险通常是受检者更为关心的数据,并且对于风险管理方案的制订更有意义。
(4)综合患者的年龄和具体的基因给出特定癌症的风险。
6.1.4 总体评估
专家共识10:遗传性妇科肿瘤的风险评估受到遗传背景、生活方式、健康状况等因素的影响,需要根据每例患者的不同致病变异基因及其具体情况,提供个性化的风险评估和管理建议(推荐强度:D)。
6.2 家族/肿瘤遗传易感基因高风险人群的筛查要点
专家共识11:不同遗传性癌症综合征人群开始筛查的年龄和筛查方法不同。① 遗传性卵巢癌:从30~35岁起,每6个月进行1次妇科检查、血清CA12-5检测和TVS检查(推荐强度:B)。② 遗传性子宫内膜癌:可从30岁起每年1次妇科检查、TVS和血清CA12-5检查,30~35岁起可考虑1~2年1次子宫内膜活检,绝经后女性每年常规经阴道彩超检查(推荐强度:B)。③ 遗传性宫颈癌:有性生活的PJS女性,应从18~20岁开始每年进行1次妇科检查和子宫颈细胞学涂片筛查;阴道出现大量水样分泌物、盆腔肿物时应进行肿瘤遗传学相关咨询(推荐强度:B)。
6.3 遗传性妇科肿瘤的靶向治疗
专家共识12:肿瘤靶向治疗和免疫治疗的临床应用高度依赖于相应的基因检测结果。① PARP抑制剂:BRCA1/2或其他同源重组修复(HRR)通路相关基因变异患者容易获益(推荐强度:A)。② 免疫治疗:肿瘤变异负荷及MMR缺陷/高度MSI均是肿瘤免疫治疗效果预测的生物标志物(推荐强度:B)。③ 鼓励遗传性妇科肿瘤患者参加临床试验(推荐强度:C)。
6.4 遗传性妇科肿瘤的预防措施
专家共识13:① 目前遗传性卵巢癌尚无有效的筛查手段,降低风险的输卵管-卵巢切除术(RRSO)是最有效的预防措施(推荐强度:A)。② RRSO能够显著地降低BRCA相关HBOCS(以及HRR相关基因胚系变异)、LS女性卵巢癌及子宫内膜癌的发病风险(推荐强度:B)。③ 口服避孕药是遗传性卵巢癌预防性药物治疗中唯一被文献报道有效的药物,但数据有限,不予常规推荐,在临床试验之外不推荐降低风险的输卵管切除术或输卵管切除术随后的延迟卵巢切除术(推荐强度:C)。④ 鼓励健康女性携带者在推荐的RRSO年龄之前完成生育计划,如不可行,可在年轻时提供卵母细胞或胚胎冷冻保存(推荐强度:A)。
6.5 RRSO的经济价值
专家共识14:RRSO在多数情况下是经济型干预方案,预防性手术的经济性与是否携带BRCA1/2致病性变异、卵巢癌发病风险、年龄及绝经等不同因素密切相关(推荐强度:A)。
6.6 遗传易感基因辅助生殖家族阻断技术及安全性
专家共识15:基于ACMG/ClinGen/AMP序列变异指南已经评级为致病或疑似致病的基因变异,且致病基因与肿瘤关系明确的,可考虑通过PGT-M助孕。在孕前通过采取一级预防措施可以阻断肿瘤胚系致病变异的家族垂直传递(推荐强度:B)。
7、妇科肿瘤遗传咨询的伦理学原则
专家共识16:遗传性肿瘤的遗传咨询知情同意书必须经过伦理委员会严格审查,患者签署知情同意书,应该尊重个人隐私和自主权,提供准确和全面的信息,尊重患者的文化和信仰,保护患者家庭成员的权益,遵守伦理学和法律规定(推荐强度:D)。
来源:中国三级妇产科医院/妇幼保健院联盟妇科肿瘤遗传咨询协作组, 中国抗癌协会中西整合子宫内膜癌专业委员会. 妇科肿瘤遗传咨询专家共识(2023年版)[J]. 中国癌症杂志, 2023, 33 (11): 1041-1064.
本材料由阿斯利康支持,仅供医疗卫生专业人士参考。
审批编号:CN-147410
过期日期:2025-11-14
 妇产科在线APP下载
妇产科在线APP下载













