卵巢癌是女性生殖系统常见的恶性肿瘤之一,由于其早期症状不明显,多数患者确诊时已处于晚期,预后较差。近年来,PARP抑制剂在晚期卵巢癌患者的治疗中取得了显著进展,为患者带来了生的希望。然而,随着其广泛应用,PARP抑制剂的安全性问题也日益受到关注。了解其作用机制和不良反应管理策略,对于优化卵巢癌患者的治疗至关重要。在本文中,中国医科大学附属盛京医院高嵩教授、吉林大学第一医院杨雷教授将和大家探讨PARP抑制剂的作用机制与不良反应管理。
一、2024年Nature发表研究论文,可能“颠覆”对PARP抑制剂作用机制的理解
杨雷教授:PARP抑制剂是一类靶向抑制PARP1/2蛋白的药物,主要对BRCA1/2突变或HRD阳性的肿瘤细胞产生“合成致死”效应,从而发挥抗肿瘤作用。既往认为,PARP抑制剂的“合成致死”效应主要涉及两个方面,即抑制PARP-1的催化活性(简称“抑制”)和对PARP的捕获(简称“捕获”)(图1)[1]。
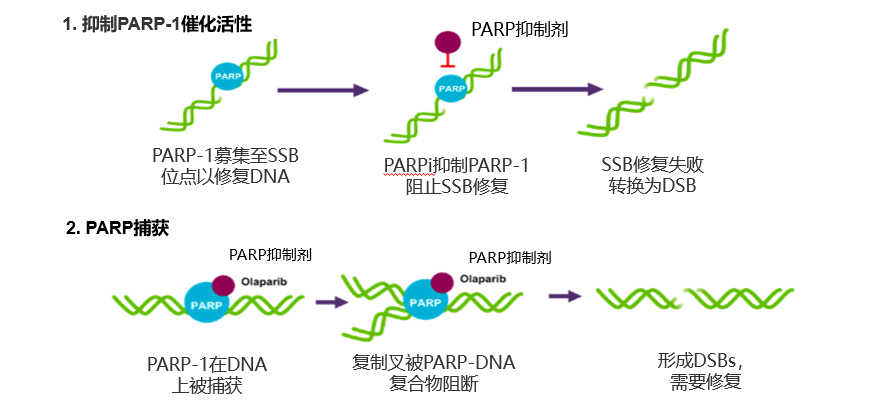
图1. PARP抑制剂“合成致死”效应的两种主要机制。
然而,就在科学家认为PARP抑制剂发挥“合成致死”效应的机制已经基本探明的时候,2024年Nature杂志发表了一篇可能颠覆传统认知的研究论文。瑞士日内瓦大学Thanos D. Halazonetis团队进行的最新体外研究显示,PARP抑制剂是通过抑制PARP1的活性诱发转录-复制冲突,进而导致DNA损伤。此外,Halazonetis团队还发现,仅仅抑制PARP1酶活性就足以诱导同源重组缺陷细胞的死亡。这些发现让大家对PARP抑制剂的“合成致死”作用有了全新的认知,也有助于研究人员进一步改良PARP抑制剂的疗效和副作用[2]。
二、关注PARP抑制剂不良反应
高嵩教授:PARP抑制剂的最新作用机制提示,PARP抑制剂“合成致死”效应主要是由于无法修复由转录-复制冲突,进而导致DNA损伤。因此,研究者认为,降低捕获潜能可能减低PARP抑制剂的毒性,而不影响疗效。
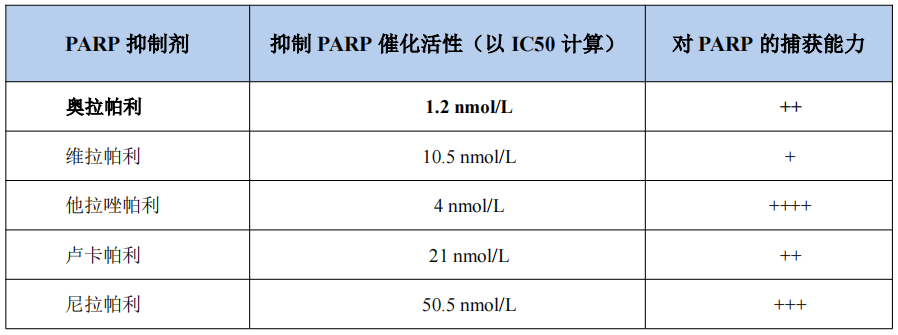
有研究测定了多种PARP抑制剂对PARP催化活性的抑制作用以及对PARP的捕获能力。其中奥拉帕利对PARP的半抑制浓度(IC50)为1.2 nmol/L,卢卡帕利的IC50为21 nmol/L,尼拉帕利的IC50则为50.5 nmol/L。至于对PARP的捕获能力,奥拉帕利、卢卡帕利的捕获能力中等(++),尼拉帕利的捕获能力较强(+++)(表1)[3]。此外,有研究表明,PARP抑制剂不同的捕获能力可能与骨髓毒性有关[4]。
表1. 部分PARP抑制剂抑制PARP催化活性的能力及对PARP的捕获能力
PARP抑制剂的常见不良反应包括贫血、中性粒细胞减少、血小板减少、胃肠道反应、疲劳和神经毒性等。一项荟萃分析纳入6项随机对照试验(RCTs),共2270例卵巢癌患者,评估3种PARP抑制剂(奥拉帕利、尼拉帕利、卢卡帕利)与安慰剂在安全性上的差异。结果显示,3种PARP抑制剂的不良反应风险存在差异,如图2所示[5]。
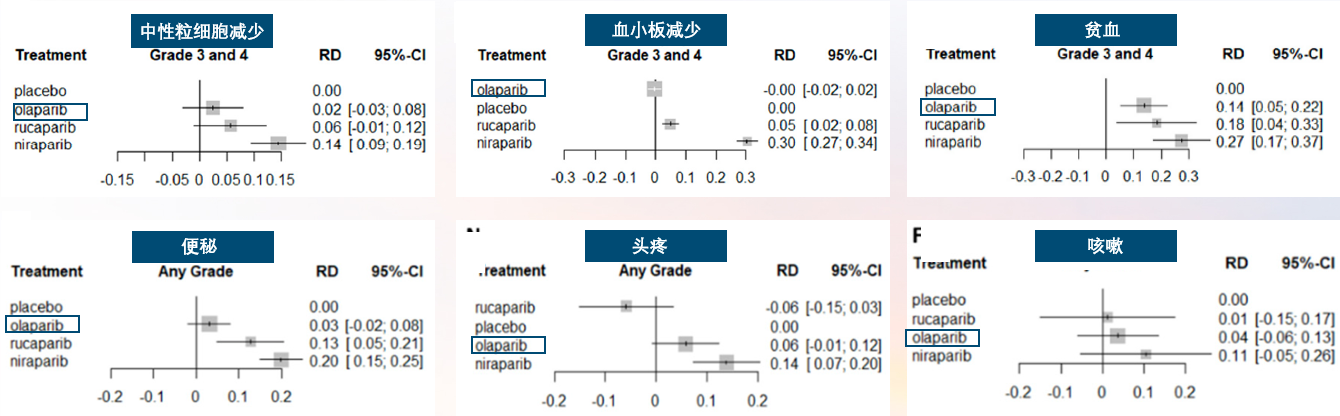
图2. PARP抑制剂安全性荟萃分析。
目前国内用于晚期卵巢癌患者治疗的PARP抑制剂主要有奥拉帕利、尼拉帕利和氟唑帕利。在卵巢癌患者PARP抑制剂一线维持治疗中,SOLO1研究显示,奥拉帕利组39.6%的患者发生≥3级不良事件(AE),13%的患者发生严重AE,52.7%的患者因AE致中断或延迟用药,28.8%的患者因AE降低剂量,11.9%的患者因AE终止治疗[6]。PRIMA研究结果显示,尼拉帕利组70.5%的患者发生≥3级AE,32.2%的患者发生严重AE,79.5%的患者因AE致中断或延迟用药,70.9%的患者因AE降低剂量,12.0%的患者因AE终止治疗[7]。FZOCUS-1研究显示,氟唑帕利组44.6%的患者发生≥3级治疗相关不良反应(TRAE),12.3%的患者发生严重TRAE,0.7%的患者因TRAE终止治疗[8]。
在铂敏感复发卵巢癌患者PARP抑制剂维持治疗中,SOLO2研究显示,奥拉帕利组36.4%的患者发生≥3级AE,25.0%的患者因AE降低剂量,11.0%的患者因AE终止治疗[9]。NOVA研究结果显示,尼拉帕利组74.1%的患者发生≥3级AE,66.5%的患者因AE降低剂量,14.7的患者因AE终止治疗[10]。FZOCUS-2研究显示,氟唑帕利组47.9%的患者发生≥3级AE,40.1%患者因AE治疗中断,24.6%因AE降低剂量,1.2%的患者因AE终止治疗[11]。
三、PARP抑制剂不良反应管理
杨雷教授:PARP抑制剂的不良反应在用药前3个月发生率较高,大部分为轻中度(1~2级),耐受性优于化疗。其不良反应具有明显的剂量相关性,多数通过减量、停药、对症处理可以得到缓解[12]。
PARP抑制剂血液学不良反应管理
(1)贫血管理
当血红蛋白≥80 g/L时,可在严密监测下用药,同时排除因缺铁、维生素B12、叶酸和甲状腺功能异常引起的贫血,可给予补充铁剂、叶酸、促红细胞生成素治疗。当血红蛋白<80 g/L时,建议暂停用药,给予相应纠正贫血治疗;如停药28天后血红蛋白仍未恢复至可接受水平,建议终止用药[12]。
(2)血小板减少管理
血小板减少发生隐匿,常表现为无症状或皮肤黏膜少量出血,较少发生严重的内脏出血,多在用药后第1个月出现,在2~3个月后逐渐恢复,可给予促血小板生长因子和输血小板治疗[12]。
(3)中性粒细胞减少管理
中性粒细胞减少常出现在治疗前3个月,大多数为轻中度,用药时不建议给予粒细胞集落刺激因子(G-CSF)预防中性粒细胞减少,不推荐使用长效G-CSF治疗,可使用短效rhG-CSF[12]。
高嵩教授:PARP抑制剂非血液学不良反应管理
(1)胃肠道毒性管理
① 恶心、呕吐:最常见的胃肠道毒性,可预防性使用止吐药物,建议清淡饮食,避免进食辛辣刺激性食物,服药后多饮水和睡前服药可减轻恶心、呕吐症状[12]。
② 腹泻:轻中度腹泻可通过调节饮食、补充水分、口服止泻药治疗,严重腹泻者需静脉输液、补充电解质并服用止泻药物[12]。
③ 便秘:轻中度便秘可使用乳果糖或开塞露改善症状,对于直肠完全梗阻或粪便嵌塞,可给予灌肠治疗[12]。
④ 食欲减退:通过改善食物烹饪方法或增加调味剂进行改善[12]。
(2)疲劳管理
疲劳是PARP抑制剂的常见不良反应之一,建议用药时自我监测,同时注意消除引起疲劳的诱因[12]。
(3)神经毒性管理
神经毒性可表现为失眠、头痛等症状,在出现相关症状时需排除中枢神经受累、内分泌异常等,建议在专科医生指导下进行睡眠教育和药物治疗[12]。
(4)心血管毒性管理
心血管毒性症状包括血压升高、心悸等,建议治疗开始前充分控制高血压。需要注意的是,CCB类降压药通常经过细胞色素酶P450进行代谢,与奥拉帕利、氟唑帕利、帕米帕利等存在药物间相互作用,具有潜在的毒性增加风险,需注意评估[12]。
四、小结
高嵩教授/杨雷教授:近期Nature杂志发表的Halazonetis团队研究,在一定程度革新了PARP抑制剂的“合成致死”机制,强调对PARP酶的抑制是“合成致死”的关键作用。PARP抑制剂不同的捕获能力可能与骨髓毒性有关。PARP抑制剂常见的不良反应包括中性粒细胞减少、血小板减少、贫血、胃肠道反应等,其相关不良反应大多为轻中度。了解并妥善管理这些不良反应对于优化卵巢癌患者的治疗方案至关重要。随着对PARP抑制剂研究的不断深入,将为卵巢癌患者的治疗带来更多希望。
专家简介

高嵩 教授
中国医科大学附属盛京医院妇科肿瘤病房主任
主任医师、硕士研究生导师
中华医学会放射肿瘤治疗学分会第九届委员会妇科肿瘤学组委员
中国医师协会放射肿瘤治疗医师分会妇科肿瘤放疗学组委员
中国医师协会放射肿瘤治疗医师分会近距离治疗学组委员
中国抗癌协会妇科肿瘤整合康复委会委员
中国医药教育协会妇科专业委员会第二届委员会委员
中国研究型医院学会精准医学与肿瘤 MDT 专业委员会妇科肿瘤学组委员

杨雷 教授
吉林大学第一医院肿瘤中心主任医师
医学博士、硕士生导师
中国抗癌协会肿瘤营养与支持治疗专业委员会精准肿瘤营养学组常委
吉林省研究型医院女子肿瘤学专业委员会副主任委员兼秘书长
吉林省老年肿瘤协会常委
吉林省生物治疗学会第二届理事会常务理事
吉林省生命关怀协会肿瘤舒缓治疗专业委员会常委
北京医学奖励基金会肺癌医学青年专家委员会委员
参考文献(向上↑滑动查看全部)
[1] Min A, Im SA. PARP Inhibitors as Therapeutics: Beyond Modulation of PARylation. Cancers (Basel). 2020 Feb 8; 12(2): 394. doi: 10.3390/cancers12020394.
[2] Petropoulos M, Karamichali A, Rossetti GG, et al. Transcription-replication conflicts underlie sensitivity to PARP inhibitors. Nature. 2024 Apr; 628(8007): 433-441. doi: 10.1038/s41586-024-07217-2.
[3] Konecny GE, Kristeleit RS. PARP inhibitors for BRCA1/2-mutated and sporadic ovarian cancer: current practice and future directions. Br J Cancer. 2016 Nov 8; 115(10): 1157-1173. doi: 10.1038/bjc.2016.311.
[4]Hopkins TA, Ainsworth WB, Ellis PA, et al. PARP1 Trapping by PARP Inhibitors Drives Cytotoxicity in Both Cancer Cells and Healthy Bone Marrow. Mol Cancer Res. 2019 Feb;17(2):409-419. doi: 10.1158/1541-7786.MCR-18-0138.
[5] Stemmer A, Shafran I, Stemmer SM, et al. Comparison of Poly (ADP-ribose) Polymerase Inhibitors (PARPis) as Maintenance Therapy for Platinum-Sensitive Ovarian Cancer: Systematic Review and Network Meta-Analysis. Cancers (Basel). 2020 Oct 18; 12(10): 3026. doi: 10.3390/cancers12103026.
[6] Banerjee S, Moore KN, Colombo N, et al. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2021 Dec; 22(12): 1721-1731. doi: 10.1016/S1470-2045(21)00531-3.
[7] González-Martín A, Pothuri B, Vergote I, et al.Niraparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med. 2019 Dec 19; 381(25): 2391-2402. doi: 10.1056/NEJMoa1910962.
[8] L. Wu,et al. Fuzuloparib as maintenance therapy in patients with advanced ovarian cancer after a response to first-line platinum-based chemotherapy: Results from a randomized, placebo-controlled, phase III trial.2024 SGO.
[9] Poveda A, Floquet A, Ledermann JA, et al. Olaparib tablets as maintenance therapy in patients with platinum-sensitive relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a final analysis of a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2021 May; 22(5): 620-631. doi: 10.1016/S1470-2045(21)00073-5.
[10] Wu XH, Zhu JQ, Yin RT, et al. Niraparib maintenance therapy in patients with platinum-sensitive recurrent ovarian cancer using an individualized starting dose (NORA): a randomized, double-blind, placebo-controlled phase III trial. Ann Oncol. 2021 Apr; 32(4): 512-521. doi: 10.1016/j.annonc.2020.12.018.
[11]Li N, Zhang Y, Wang J, et al. Fuzuloparib Maintenance Therapy in Patients With Platinum-Sensitive, Recurrent Ovarian Carcinoma (FZOCUS-2): A Multicenter, Randomized, Double-Blind, Placebo-Controlled, Phase III Trial. J Clin Oncol. 2022 Aug 1; 40(22): 2436-2446. doi: 10.1200/JCO.21.01511.
[12] 中国抗癌协会妇科肿瘤专业委员会. PARP抑制剂不良反应管理的中国专家共识(2021年版) [J]. 中国实用妇科与产科杂志, 2021, 37 (11): 1119-1130. DOI:10.19538/j.fk2021110111.
声明:本材料由阿斯利康支持,仅供医疗卫生专业人士参考。
审批编号:CN-148451
过期日期:2025-11-27
 妇产科在线APP下载
妇产科在线APP下载













