多项临床研究证实,BRCA突变或HRD阳性晚期卵巢癌患者能从PARP抑制剂单药或联合贝伐珠单抗维持治疗中显著获益,有效延长无进展生存期(PFS)甚至总生存期(OS)。对比而言,HRD阴性晚期卵巢癌患者的维持治疗的效果常没有那么理想。然而,卵巢癌患者中仅约50%患者携带HRD[1]。那么,对于剩下的一半HRD呈阴性的患者,该如何选择维持治疗方案才能实现临床最大获益?PARP抑制剂是否为优选方案?
在本文中,复旦大学附属肿瘤医院任玉兰教授将立足循证数据及指南,全方位阐述HRD阴性卵巢癌患者如何选择维持治疗方案。
一、HRD阳性晚期卵巢癌患者一线维持治疗
目前,卵巢癌的标准治疗方案是手术+化疗+PARP抑制剂维持治疗。根据基因检测结果,可以将新诊断晚期卵巢癌患者分为BRCA突变、BRCA野生型HRD阳性以及HRD阴性3类,不同的基因分型最佳的维持治疗方案也不同。
新诊断的BRCA野生型晚期卵巢癌患者,《2024NCCN卵巢癌指南》推荐:化疗时未联合贝伐珠单抗达CR/PR,可选择尼拉帕利、卢卡帕利维持治疗,主要基于高循证级别的PRIMA、ATHENA-MONO的III期临床研究结果;新诊断的BRCA野生型/HRD阳性晚期卵巢癌患者,化疗时联合贝伐珠单抗达CR/PR,可选择奥拉帕利联合贝伐珠单抗维持治疗,这是基于高循证级别的PAOLA-1随机III期临床研究,证据等级为1类,同时指南新增“若奥拉帕利不能耐受,可选择尼拉帕利联合贝伐珠单抗”,这是基于II期单臂的OVARIO研究,证据等级为2A类[9]。
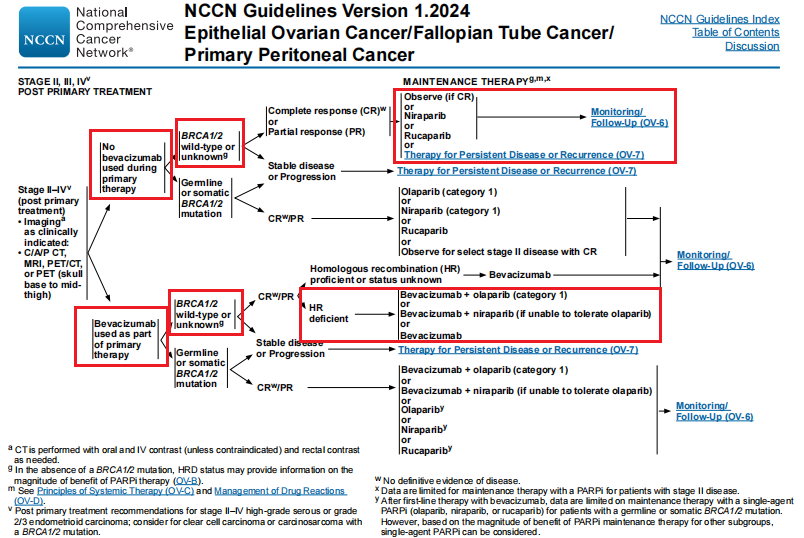
图1:2024NCCN指南一线维持治疗推荐
完整证据链,强力保障PARP抑制剂脱颖而出
SOLO-1研究是一项随机、双盲、安慰剂对照、多中心的III期临床研究,用于评估奥拉帕利作为一线单药维持治疗在新诊断BRCA1/2突变的晚期卵巢癌患者中的疗效和安全性。在整个卵巢癌临床研究探索历史中,SOLO-1研究是一项“史诗级”的突破。它首次证实了奥拉帕利用于BRCA突变卵巢癌患者的一线维持治疗能显著降低复发风险(中位PFS:56.0个月 vs 13.8个月;HR=0.33;95% CI 0.25~0.43)。最新随访数据也提示,奥拉帕利使患者的总体死亡风险显著降低(7年OS率:67.0% vs 46.5%;中位OS:NR vs 75.2个月;HR=0.55;95% CI 0.40~0.76)[2]。
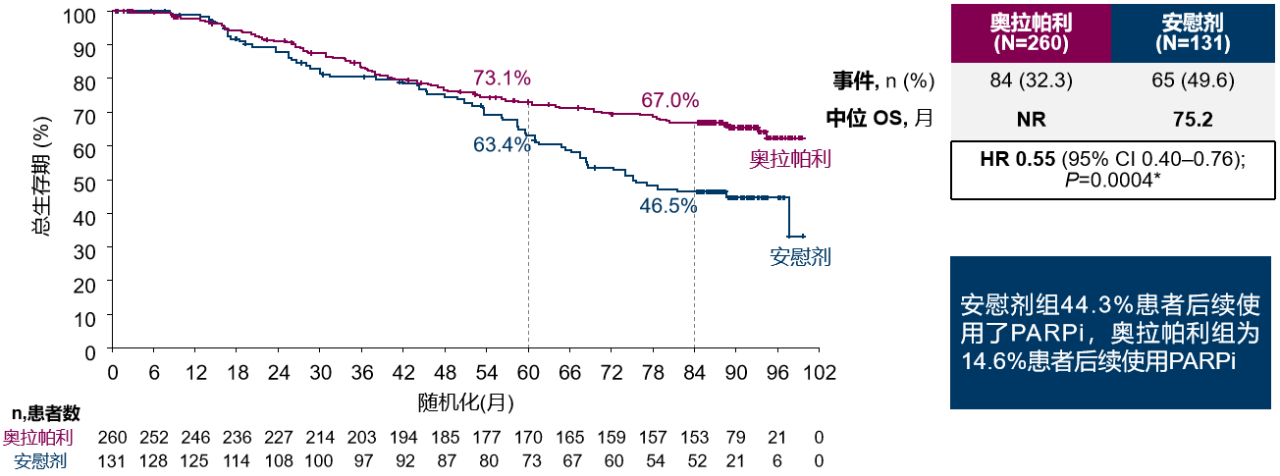
图2:SOLO-1研究的中位OS结果
PAOLA-1是一项随机、双盲、III期临床研究,旨在评估接受含铂化疗+贝伐珠单抗治疗的新诊断晚期卵巢癌患者使用奥拉帕利+贝伐珠单抗 vs 安慰剂+贝伐珠单抗一线维持治疗的疗效。结果显示,奥拉帕利显著改善HRD阳性患者中位PFS,达46.8个月,较对照组延长29.2个月;中位OS分别为75.2个月 vs 57.3个月,5年OS率分别为65.5% vs 48.4%(见图1)。继SOLO-1研究后,PAOLA-1研究将奥拉帕利的卵巢癌一线维持治疗适应症从BRCA突变人群扩展至HRD阳性人群[3]。
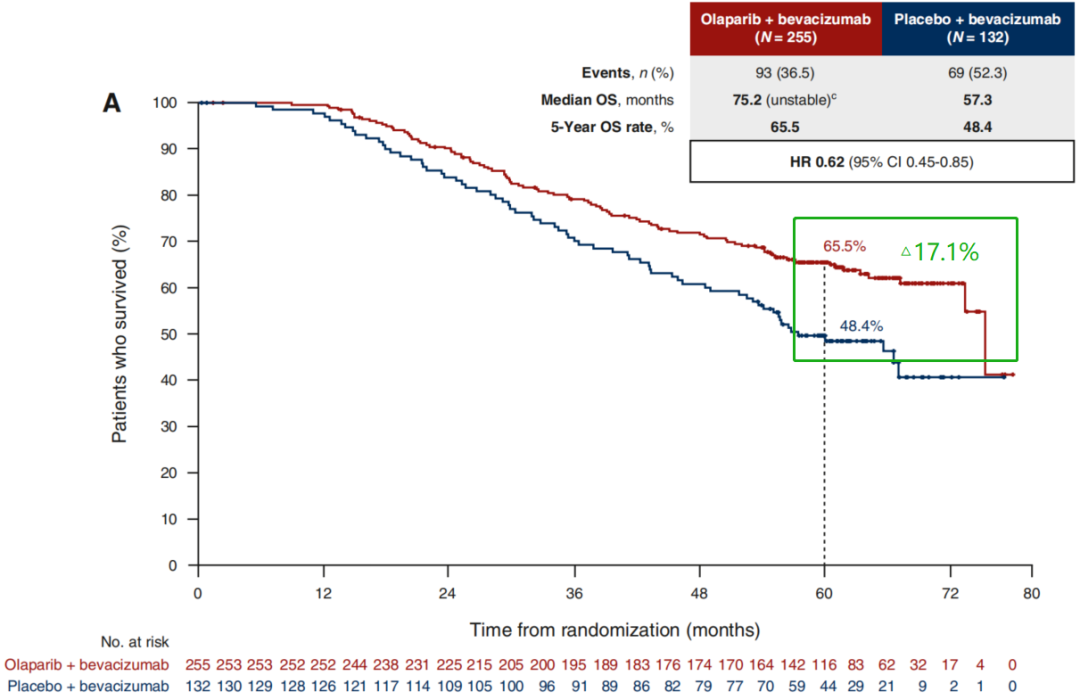
图3:PAOLA-1研究中HRD阳性人群OS结果
紧随奥拉帕利,尼拉帕利及卢卡帕利也逐一在晚期卵巢癌的维持治疗中被证实可有效延长PFS。此外,在2024 欧洲内科肿瘤学会(ESMO)年会上,PRIMA研究的OS等最新数据发布。在整体人群中,尼拉帕利较安慰剂降低34%的复发或死亡风险,中位PFS分别为13.8个月和8.2个月(HR=0.66,95%CI 0.56~0.79)中位OS为46.6个月vs安慰剂组48.8个月(HR=1.01,95% CI 0.84~1.23)。在HRD阳性人群中,两组的中位PFS分别为24.5个月和11.2个月(HR=0.52,95%CI 0.40~0.68),中位OS为71.9个月 vs 69.8个月,HR=0.95。在亚组分析中,HRD阴性患者的中位PFS时间分别为8.4个月和5.4个月(HR=0.65,95%CI 0.49~0.87),其获益程度小于BRCA突变患者和HRD阳性患者[4]。
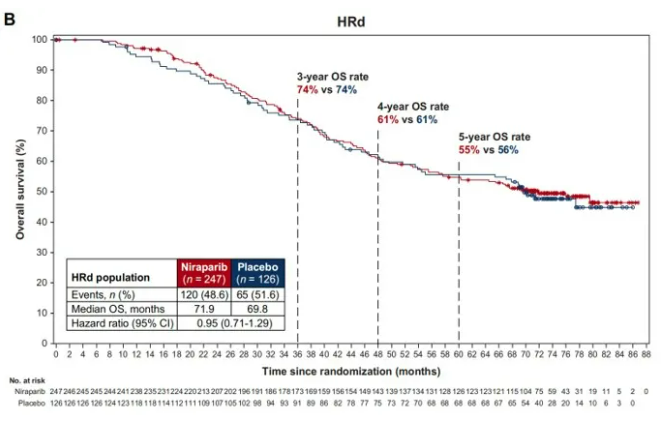
图4、PRIMA研究HRd人群OS结果
在中国人群中开展的PRIME研究显示,在新诊断卵巢癌患者全人群中,尼拉帕利组、安慰剂组的中位PFS分别为24.8个月和8.3个月(HR=0.45,95%CI 0.34~0.60),但由于研究开展的时间较短,OS数据尚未成熟。该研究采用尼拉帕利个体化起始剂量,安全性相较于PRIMA研究得到改善[5]。
ATHENA-MONO研究是一项国际性、随机、双盲、III期试验,分析卢卡帕利作为卵巢癌患者一线维持治疗的效果。结果显示,卢卡帕利组与安慰剂组的中位PFS为20.2个月和9.2个月(HR=0.52,95%CI 0.40~0.68)。与全人群相比,HRD队列的PFS数据更高,接受卢卡帕利的患者中位PFS为28.7个月[6]。
由此可见,在我国,对于BRCA突变患者,奥拉帕利、尼拉帕利等PARP抑制剂单药维持治疗均能带来确切获益;对于初始治疗化疗联合贝伐珠单抗BRCA野生型/HRD阳性患者,奥拉帕利+贝伐珠单抗效果显著。然而,在HRD阴性或未知的患者中,PARP抑制剂单药或联合贝伐珠单抗维持治疗作用有限。如何使HRD阴性患者实现临床获益是我们目前的治疗难点,需要进一步的探索。
二、新诊断HRD阴性卵巢癌维持治疗方案
首先,在讨论不同方案的疗效之前,先来看看最权威的指南对维持治疗方式的推荐。
对于新诊断的BRCA野生型/HRD阴性卵巢癌,《2024NCCN卵巢癌指南》指出,化疗达CR/PR后,如果患者在化疗时联用了贝伐珠单抗,那么可以选择贝伐珠单抗进行维持治疗,这是主要基于GOG-218研究;如果患者在化疗时没有联用贝伐珠单抗,可以选择尼拉帕利进行维持治疗,这项推荐主要基于PRIMA及PRIME研究[9]。相较于2024NCCN指南,对于化疗时联合贝伐珠单抗的患者,我国今年新发布的《卵巢癌临床实践指南2024版》也推荐尼拉帕利+贝伐珠单抗维持治疗(2B类);化疗时未联合贝伐珠单抗的患者,《卵巢癌临床实践指南2024版》及《CSCO卵巢癌诊疗指南2024》新增加了氟唑帕利一线维持治疗,主要是基于FZOCUS-1,HRD阴性卵巢癌亚组中位PFS分别16.6个月 vs 5.6个月。
贝伐珠单抗被批准用于晚期卵巢癌的维持治疗是基于GOG-218研究的阳性结果。该研究纳入1873例受试者,被分为3组。 第1组患者:正常化疗;第2组患者:化疗中加入贝伐珠单抗;第3组患者:化疗中加入贝伐珠单抗,化疗后贝伐珠单抗进行维持治疗。研究结果显示,第3组和第1组相比,疾病进展的风险降低了28%,中位PFS提高3.8个月(14.1个月 vs. 10.3个月)。 然而,3组的OS结果分析显示,组1(41.1个月)、组2(40.8个月)、组3(43.4个月)并没有显著差异,贝伐珠单抗并不能带来总生存期获益[8]。
总之,对于晚期卵巢癌患者,无论HRD状态如何,我们需要从卵巢癌全程管理层面出发,统筹安排贝伐珠单抗和PARP抑制剂的使用时机,以求获得最佳疗效。
三、铂敏感复发性卵巢癌维持治疗方案
基于SOLO2、OPNION、L-MOCA、NOVA等研究,《2024NCCN卵巢癌指南》推荐:铂敏感复发患者,如果既往治疗未使用过PARP抑制剂,或者既往使用PARP抑制剂治疗时疾病未进展,维持治疗优先考虑选择PARP抑制剂,但需进行基因检测确定携带BRCA1/2胚系或体系基因突变。携带胚系BRCA突变可使用尼拉帕利;携带胚系或体系BRCA突变可使用奥拉帕利或卢卡帕利。鉴于Study-19,NOVA,ARIEL-3等临床研究的总生存时间(OS)数据,在BRCAwt队列中使用PARP抑制剂并无OS获益,因此,指南不再推荐奥拉帕利、尼拉帕利和卢卡帕利用于BRCAwt铂敏感复发患者的维持治疗[9]。

图5:2024NCCN指南铂敏感维持治疗推荐
与奥拉帕利相关的研究
SOLO2研究[10,11]是一项随机、双盲、安慰剂对照、多中心Ⅲ期临床研究。结果显示,奥拉帕利组和安慰剂组患者的中位PFS分别为19.1个月和5.5个月(HR=0.30,95%CI:0.22~0.41,P<0.0001);OS分析显示,奥拉帕利组和安慰剂组患者的中位OS分别为51.7个月和38.8个月(HR=0.74,95%CI 0.54~1.00,P=0.054),安慰剂组中38%的患者后续接受PARP抑制剂治疗,校正安慰剂组交叉用药后,奥拉帕利组和安慰剂组患者的中位OS分别为51.7个月和35.4个月(HR=0.56,95%CI 0.35~0.97)。本研究首次证实奥拉帕利维持治疗可以使BRCA突变铂敏感复发卵巢癌患者OS有临床意义的获益。
OPNION研究[12]是一项单臂、开放标签的IIIb期临床研究,纳入既往接受过≥2线含铂方案治疗的非gBRCA突变铂敏感复发卵巢癌患者。研究结果显示,对于非gBRCA突变的铂敏感复发患者,使用奥拉帕利单药维持治疗的中位PFS为9.2个月;中位OS为32.7个月;24个月和30个月 Kaplan-Meier OS率分别为65.8%和54.9%。
L-MOCA 研究是针对亚洲铂敏感复发性卵巢癌患者的Ⅲ期单臂研究,其中91.5% 为中国患者,中期OS数据显示,中位随访时间为40个月,ITT人群mOS达到了54.4个月,42个月的OS率为59.7%,中位PFS为16.1个月(95%CI 13.3~18.3);其中BRCAm亚组的mOS还未达到(51.9 个月~NE),中位PFS达21.2个月(95%CI 16.4~24.9);BRCA野生型/HRD阳性亚组和HRP亚组的mOS分别为54.6个月和37.2个月。研究提示,奥拉帕利在亚洲铂敏感复发卵巢癌患者展现出长期生存获益及良好的安全性,且无论BRCA和HRD的状态如何,在中国奥拉帕利铂敏感复发人群适应证未发生变化。这是继SOLO2、OPINION研究后奥拉帕利疗效的又一力证[18]。
与尼拉帕利相关的研究
NOVA研究是一项随机、双盲、安慰剂对照的III期研究,评估尼拉帕利维持治疗铂敏感复发卵巢癌患者。中位随访16.9个月时进行的初步分析结果显示,无论胚系BRCA突变阴性或阳性,尼拉帕利维持治疗均可延长中位PFS[16]。然而,最终OS分析结果发现,在非胚系BRCA突变队列中,尼拉帕利组和安慰剂组中位OS分别为31.0个月和34.8个月,HR为1.06。
NORA研究是对中国铂敏感复发性卵巢癌患者开展的采用尼拉帕利个体化起始剂量的Ⅲ期随机对照研究。OS 最终分析显示,gBRCA突变患者的mOS分别是56个月和47.6个月(HR=0.86;95%CI 0.46~1.58),安慰剂组中57.1%的患者后续接受PARP抑制剂治疗;非gBRCA突变患者的mOS分别是46.5个月和46.9个月(HR=0.87;95%CI 0.56~1.35),提示尼拉帕利个体化起始剂量可为不同BRCA状态的中国铂敏感复发性患者带来OS获益趋势。
四、卵巢癌治疗的最新研究进展
1、卵巢癌靶向治疗进展
(1)靶向FRα的ADC药物
被誉为“魔法子弹”的ADC药物是肿瘤领域的新秀,为卵巢癌的治疗带来的新选择、新希望。基于SORAYA、MIRASOL、PICCOLO研究的阳性结果,全球首个针对FRα阳性卵巢癌的ADC药物索米妥昔单抗(MIRV)被2024NCCN卵巢癌指南推荐用于铂耐药复发性卵巢癌、铂敏感复发性卵巢癌。其中,PICCOLO研究是一项单臂II期临床试验,旨在评估MIRV在PSOC患者中的疗效和安全性。截至2024年1月17日,共有79例患者入组。结果显示,MIRV治疗患者的ORR为51.9%。研究结果表明MIRV在FRα高表达的PSOC患者中展现出显著的抗肿瘤活性,并且具有良好的耐受性。
未来可研究的方向为MIRV联合其他药物的效果、可否将MIRV提到一线治疗取代紫杉醇等。虽然MYRASOL研究成效较好,但仍需认识到ADC的局限性,且SORAYA研究中初筛时仅有36%的患者 存在FRα高表达。对耐药复发患者的治疗探索仍在继续,针对其他靶点和有效载荷不同细胞毒性药物的ADC也在相应研发中。
(2)靶向HER2的药物
尽管在卵巢癌中HER2基因扩增较为罕见,但在一些高表达HER2的卵巢癌患者中,HER2靶向药物如帕妥珠单抗等显示出治疗效果。其临床应用价值仍有很大的探索空间。
2、卵巢癌免疫治疗进展
免疫治疗在登上肿瘤治疗用药的大舞台后,在卵巢癌治疗中“屡屡碰壁”,比如IMagyn050、GOG 3015等研究均未取得阳性结果。但是,免疫治疗作为一种极具前景的治疗手段,有望为卵巢癌患者带来更多获益可能,因此如何进一步发挥免疫治疗疗效,相关探索一直在进行中。
基于联合用药的协同增效理论,目前提出的方案包括免疫检查点抑制剂(ICIs)联合化疗、ICIs联合抗血管生成等。另外,研究显示,PARP抑制剂可增加肿瘤突变负荷、提高PD-L1表达,以增强ICIs的反应率,由此PARP抑制剂与抗PD-1/PD-L1单抗存在协同效应。现在,PARP抑制剂+抗PD-1/PD-L1单抗的临床研究也正在如火如荼地开展,以期为临床注入新活力。
四、小结
一些新的治疗方案正在探索中,已经尝试的治疗模式包括化疗联合免疫、化疗加免疫加抗血管生成以及化疗联合免疫调节剂等,相信未来有更多的临床研究能给卵巢癌患者带来生存获益。但在目前,对于HRD阴性卵巢癌患者,如果初始治疗中加入了贝伐珠单抗的患者,在达到缓解后可继续使用贝伐珠单抗一线维持治疗;若患者不幸出现复发,铂敏感复发的患者也可以尽快开启PARP抑制剂二线维持治疗。
任玉兰 教授
复旦大学附属肿瘤医院妇科
主任医师、副教授、硕士生导师
上海医学会妇科肿瘤分会青年委员
上海医师协会妇科肿瘤专委会委员
在复旦大学附属肿瘤医院从事妇科肿瘤的临床诊疗工作近20年,擅长妇科常见恶性肿瘤的诊治,包括子宫内膜癌、卵巢癌、宫颈癌、外阴癌等。
2014年至美国M.D.Anderson癌症中心和美国斯坦福大学访问学习,至今已在国内外发表论文二十余篇,包括Gynecologic Oncology、Int J Cancer、BMC Cancer、 Int J Gynecol Cancer、中华妇产科杂志等。
参考文献:
[1]Yoshihara K, Baba T, Tokunaga H, Nishino K, Sekine M, Takamatsu S, Matsumura N, Yoshida H, Kajiyama H, Shimada M, Kagimura T, Oda K, Sasajima Y, Yaegashi N, Okamoto A, Sugiyama T, Enomoto T. Homologous recombination inquiry through ovarian malignancy investigations: JGOG3025 Study. Cancer Sci. 2023 Jun;114(6):2515-2523. doi: 10.1111/cas.15747. Epub 2023 Apr 10.
[2]DiSilvestro P, et al. SOLO1 Investigators. Overall Survival With Maintenance Olaparib at a 7-Year Follow-Up in Patients With Newly Diagnosed Advanced Ovarian Cancer and a BRCA Mutation: The SOLO1/GOG 3004 Trial. J Clin Oncol. 2023 Jan 20;41(3):609-617. doi: 10.1200/JCO.22.01549. Epub 2022 Sep 9.
[3]Lorusso D, Mouret-Reynier MA, et al. Updated progression-free survival and final overall survival with maintenance olaparib plus bevacizumab according to clinical risk in patients with newly diagnosed advanced ovarian cancer in the phase III PAOLA-1/ENGOT-ov25 trial. Int J Gynecol Cancer. 2024 Apr 1;34(4):550-558. doi: 10.1136/ijgc-2023-004995.
[4]González-Martín A, et al. Final overall survival (OS) in patients with newly diagnosed advanced ovarian cancer (OC) treated with niraparib first-line (1L) maintenance: results from PRIMA/ENGOT-OV26/GOG-3012. ESMO Congress 2024, LBA29
[5]Li N et al. Treatment With Niraparib Maintenance Therapy in Patients With Newly Diagnosed Advanced Ovarian CancerA Phase 3 Randomized Clinical Trial.JAMA Oncol. Published online July 13, 2023. doi:10.1001/jamaoncol.2023.2283.
[6]Monk BJ, Parkinson C, et al. A Randomized, Phase III Trial to Evaluate Rucaparib Monotherapy as Maintenance Treatment in Patients With Newly Diagnosed Ovarian Cancer (ATHENA-MONO/GOG-3020/ENGOT-ov45). J Clin Oncol. 2022 Dec 1;40(34):3952-3964.
[7]OVARIO, A Phase 2 Study of Niraparib + Bevacizumab in Advanced Ovarian Cancer Following Front-Line Platinum-Based Chemotherapy with Bevacizumab: Updated Analysis.2022 SGO.
[8]Tewari KS, Burger RA, Enserro D, et al. Final Overall Survival of a Randomized Trial of Bevacizumab for Primary Treatment of Ovarian Cancer. J Clin Oncol, 2019.
[9]NCCN Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer. Version 1.2024
[10]Poveda A, et al. Lancet Oncol. 2021;22(5):620-631.
[11] Poveda A, et al. ASCO 2020. Abstract no.228.
[12]Poveda Velasco AM, et al. 2022 ESMO 531P.
[15] Qing-lei Gao, et al. Overall survival (OS) in patients with platinum-sensitive relapsed ovarian cancer (PSROC) treated with olaparib maintenance monotherapy: Update from the L-MOCA trial. 2024 ASCO#5559.
[16] Mirza MR, et al. N Engl J Med. 2016;375(22):2154-2164.
[17]WU X H,ZHU J Q,YIN R T,et al. Niraparib maintenance therapy in patients with platinum-sensitive recurrent ovarian cancer using an individualized starting dose(NORA):a randomized,double-blind,placebo-controlled phase Ⅲ trial[J].Ann Oncol,2021,32(4):512-521.
[18]GAO Q,ZHU J,ZHAO W,et al. Overall survival(OS)in patients with platinum-sensitive relapsed ovarian cancer(PSROC)treated with olaparib maintenance monotherapy:Update from the L-MOCA trial[J].Journal of clinical oncology,2024,42(16-Supple):5559.
审批编号:CN-148452
过期日期:2025-11-30
 妇产科在线APP下载
妇产科在线APP下载














